
时间:2020-12-02浏览次数:6578
宫颈癌是妇科常见的恶性肿瘤,其发生发展与高危型人乳头瘤病毒(HPV)感染密切相关。动物模型是研究宫颈癌发病机制、药物筛选及治疗策略的重要工具。以下是不同造模方法、相关机制通路、关键蛋白及其临床研究关联的详细阐述:
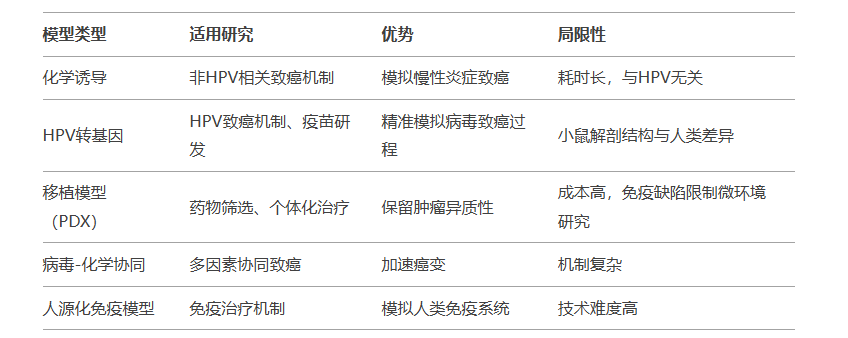
一、化学诱导模型
1. 造模方法
致癌剂:使用化学致癌剂如7,12-二甲基苯并蒽(DMBA)或甲基胆蒽(MCA)局部涂抹宫颈或阴道黏膜,诱导上皮细胞恶性转化。
特点:操作简单,但致癌周期长(需数月至1年),模型异质性高,与HPV感染无关。
2. 机制通路与关键蛋白
PI3K/AKT/mTOR通路:化学致癌剂导致DNA损伤后激活PI3K/AKT通路,促进细胞增殖并抑制凋亡。
关键蛋白:AKT、mTOR、PTEN(抑癌基因失活)。
炎症相关通路:NF-κB和STAT3持续激活,驱动慢性炎症向癌变转化。
关键蛋白:IL-6、COX-2、TNF-α。
3. 临床研究关联
PI3K抑制剂(如Alpelisib)和mTOR抑制剂(如依维莫司)已在临床试验中用于治疗复发宫颈癌(NCT04895449)。
COX-2抑制剂(如塞来昔布)被研究用于化学预防或辅助治疗。
二、HPV转基因模型
1. 造模方法
基因工程小鼠:通过基因编辑技术(如Cre-loxP系统)将HPV的致癌基因E6/E7导入小鼠宫颈上皮细胞,模拟HPV持续感染。
常用品系:K14-HPV16/E7转基因小鼠(HPV16亚型为主)。
2. 机制通路与关键蛋白
E6/E7致癌机制:
E6蛋白:通过泛素化降解p53蛋白,抑制细胞凋亡。
E7蛋白:结合并降解视网膜母细胞瘤蛋白(pRb),解除细胞周期G1/S期阻滞。
端粒酶激活:E6通过激活hTERT(端粒酶逆转录酶)促进细胞永生化。
免疫逃逸:E7抑制干扰素信号通路(如IRF-1),降低抗病毒免疫应答。
3. 临床研究关联
HPV疫苗(如Gardasil 9)的研发基于E6/E7抗原表位设计,临床试验显示可预防HPV感染及癌前病变。
靶向E6/E7的治疗:如RNA干扰(siRNA)、治疗性疫苗(如VGX-3100,III期临床试验NCT03185013)正在开发中。
三、移植模型(异种移植与PDX模型)
1. 造模方法
细胞系移植:将人宫颈癌细胞系(如HeLa、SiHa、CaSki)接种至免疫缺陷小鼠(如裸鼠、NSG小鼠)皮下或原位(宫颈部位)。
PDX模型(Patient-Derived Xenograft):将患者宫颈癌组织直接移植至小鼠,保留肿瘤异质性和微环境。
2. 机制通路与关键蛋白
HPV依赖性通路:HPV阳性细胞系(如SiHa)依赖E6/E7维持恶性表型。
EGFR/MAPK通路:在HPV阴性模型中(如C33A),EGFR过表达驱动增殖。
免疫微环境:PDX模型中可见PD-L1高表达,与T细胞浸润抑制相关。
3. 临床研究关联
抗PD-1/PD-L1抗体(如帕博利珠单抗)在PD-L1阳性宫颈癌患者中显示疗效(KEYNOTE-158试验)。
EGFR抑制剂(如西妥昔单抗)联合化疗的II期临床试验(NCT00357682)显示部分缓解。
四、病毒-化学协同诱导模型
1. 造模方法
联合HPV假病毒(如HPV16伪病毒)感染与化学致癌剂(DMBA)处理,加速癌变进程。
2. 机制通路与关键蛋白
协同致癌作用:HPV E6/E7破坏DNA修复机制(如抑制p53),化学致癌剂加重基因组不稳定性。
Wnt/β-catenin通路:β-catenin核转位促进上皮间质转化(EMT),驱动侵袭转移。
3. 临床研究关联
Wnt抑制剂(如PRI-724)在早期临床试验中探索其对转移性宫颈癌的作用。
五、免疫缺陷模型(人源化小鼠)
1. 造模方法
构建人源化免疫系统小鼠(如人CD34+造血干细胞移植至NSG小鼠),再接种HPV阳性肿瘤,研究免疫治疗响应。
2. 机制通路与关键蛋白
免疫检查点分子:PD-1/PD-L1、CTLA-4在肿瘤微环境中高表达。
T细胞耗竭标志物:TIM-3、LAG-3。
3. 临床研究关联
双免疫检查点抑制剂(如PD-1+CTLA-4联合)在晚期宫颈癌中开展试验(NCT03495882)。
总结与比较
未来研究方向
基因编辑技术:CRISPR-Cas9构建HPV整合位点特异性模型。
类器官模型:结合宫颈癌类器官与免疫细胞共培养,模拟肿瘤微环境。
多组学整合:通过单细胞测序揭示不同模型中肿瘤进化轨迹。
通过上述模型的机制研究与临床转化,可推动宫颈癌精准治疗策略的发展,如联合靶向治疗、免疫治疗及表观遗传调控(如HDAC抑制剂)的应用。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)
