促炎VS修复」巨噬细胞的生存博弈:多种功能表型如何改写疾病结局?
时间:2025-07-07 阅读:904
巨噬细胞作为免疫系统的核心组成部分,其惊人的可塑性和异质性使其在机体稳态维持、疾病发生发展中发挥多重作用。
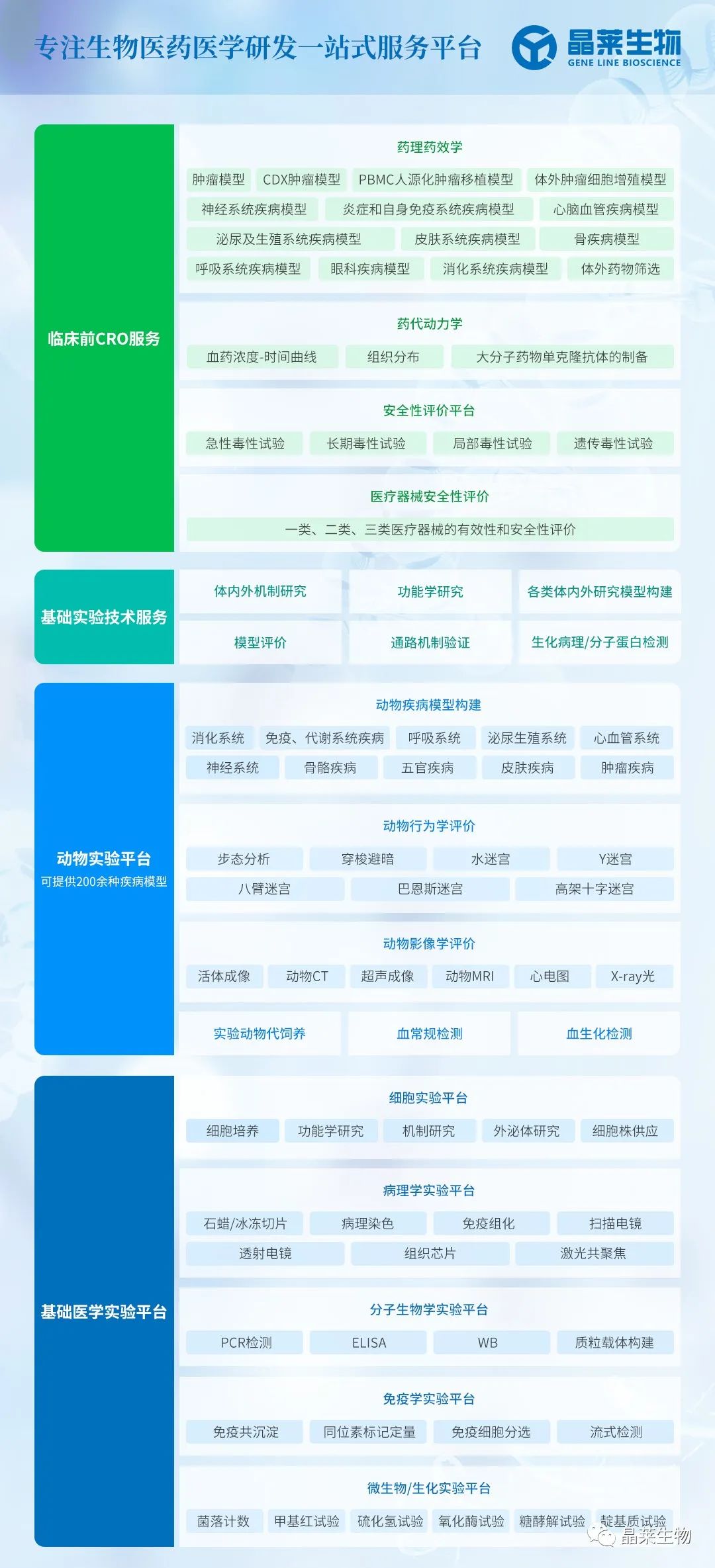
巨噬细胞的表型极化是其功能多样性的核心机制。经典活化型(M1)和替代活化型(M2)是巨噬细胞最基础的极化分类,但实际状态更为复杂。研究表明,不同来源的巨噬细胞在极化能力上存在显著差异:人多能干细胞(hPSC)和人脐血CD34+造血干/祖细胞来源的巨噬细胞在LPS刺激下可迅速分化为M1型(3小时内促炎因子达峰值),但几乎无法被IL-4诱导为M2型;相反,THP-1来源的巨噬细胞虽可双向极化,但需更长时间(9小时达峰值)且缺乏CD14、CD68等关键表面标志物。这种差异对疾病模型构建和药物筛选具有重要启示。
表1:不同来源巨噬细胞的极化特性比较
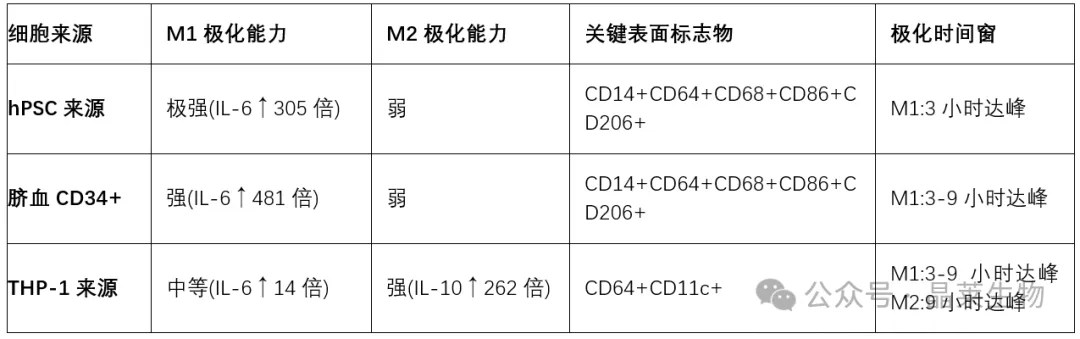
巨噬细胞的代谢重编程是其功能调控的深层机制。M1巨噬细胞以糖酵解为主,伴随TCA循环中断和琥珀酸积累,促进IL-1β分泌;而M2型则依赖氧化磷酸化和脂肪酸β氧化,支持其修复功能。
这种代谢特征不仅是能量供应方式的改变,更直接参与信号通路的调节。例如,PPARγ T166去磷酸化可促进脂质合成,积累的脂质作为信号分子触发STAT3介导的生长因子表达,从而增强组织修复功能。
巨噬细胞的多种功能表型:机制与研究策略
1. 炎症反应调控者
分子机制:M1巨噬细胞是炎症反应的核心效应细胞,其活化主要由IFN-γ和LPS通过TLR信号通路诱导,导致NF-κB等转录因子激活,进而促进iNOS、TNF-α、IL-1β等促炎因子表达。这些细胞因子形成正反馈循环,放大炎症信号并招募更多免疫细胞。同时,M1巨噬细胞通过NADPH氧化酶复合体产生大量活性氧(ROS),并通过iNOS催化生成一氧化氮(NO),直接杀伤病原体。
检测方法:
流式细胞术:检测CD86、CD40、HLA-DR等M1表面标志物
免疫荧光:观察iNOS、TNF-α等胞内蛋白分布
qRT-PCR:定量促炎因子mRNA表达水平
ELISA:检测细胞培养上清中IL-6、TNF-α等含量
2. 纤维化驱动者
分子机制:巨噬细胞通过分泌TGF-β、PDGF等细胞因子激活成纤维细胞,促使其转化为肌成纤维细胞,后者过度合成胶原蛋白等细胞外基质(ECM),导致组织纤维化。在纤维化进程中,巨噬细胞还可通过MMT(巨噬细胞-肌成纤维细胞转化)直接参与ECM沉积。
检测方法:
组织染色:Masson三色染色评估胶原沉积;免疫组化检测α-SMA、Collagen I等纤维化标志物
流式细胞术:分析巨噬细胞亚群(CD68+CD163+ M2型)比例
Western blot:检测TGF-β/Smad、PI3K-Akt通路蛋白表达
3. 血管重构调控者
分子机制:促血管生成巨噬细胞(PraM)通过分泌VEGF、FGF、ANGPT2等因子直接刺激内皮细胞增殖和迁移。同时,PraM高表达MMP-9等基质金属蛋白酶,降解基底膜为新生血管提供空间。
李汉杰团队发现PraM广泛分布于多个器官的血管周围,通过单细胞测序证实其高表达促血管生成基因(VEGFA、TNF、IL1B、CXCL8)。
检测方法:
免疫组化:CD31标记血管密度;α-SMA标记血管周细胞覆盖
体外成管实验:Matrigel基质中观察内皮细胞管状结构形成
激光散斑成像:活体评估组织血流灌注变化
4. 组织修复促进者
分子机制:M2巨噬细胞通过分泌IL-10、TGF-β等抗炎因子抑制过度炎症反应,同时产生IGF-1、VEGF等生长因子促进实质细胞增殖和血管新生。此外,M2巨噬细胞通过胞葬作用(efferocytosis)清除凋亡细胞,为组织修复创造有利微环境。
检测方法:
伤口愈合模型:测量巨噬细胞干预后伤口闭合速度
组织学分析:HE染色评估组织结构修复;Masson染色观察胶原重塑
吞噬功能检测:荧光标记凋亡细胞与巨噬细胞共培养,量化吞噬效率
5. 吞噬与胞葬执行者
分子机制:巨噬细胞通过表面受体(如清道夫受体、Tim家族受体)识别病原体或凋亡细胞表面的特定分子模式(如磷脂酰丝氨酸),激活Rac1/Cdc42介导的细胞骨架重组,形成吞噬杯包裹目标,最终在溶酶体内降解。MerTK是胞葬作用的关键受体,其表达水平直接影响凋亡细胞清除效率。
检测方法:
荧光吞噬分析:荧光标记病原体/凋亡细胞与巨噬细胞共孵育,流式或显微镜定量
溶酶体融合检测:LysoTracker标记溶酶体,共聚焦显微镜观察吞噬体-溶酶体融合
MerTK磷酸化检测:Western blot分析MerTK活化状态
6. 抗菌防御者
分子机制:巨噬细胞通过TLR等模式识别受体感知病原体,激活下游信号通路:①产生ROS/RNS直接杀伤;②自噬包裹病原体;③ 分泌细胞因子招募其他免疫细胞;④形成胞外陷阱(METs)捕获病原体。
检测方法:
菌落计数:巨噬细胞-病原体共培养后裂解细胞,平板培养计数存活菌落
活性氧检测:DCFH-DA荧光探针定量胞内ROS
自噬流分析:LC3免疫荧光观察自噬体形成
7. 抗原呈递细胞
分子机制:巨噬细胞吞噬抗原后在溶酶体内降解为肽段,与MHC-II类分子结合形成复合物转运至细胞膜,呈递给CD4+ T细胞。此过程受CIITA转录调控,并受多种免疫检查点分子调节。
检测方法:
流式细胞术:检测MHC-II、CD80、CD86表达
T细胞活化试验:CFSE标记T细胞与抗原负载巨噬细胞共培养,分析T细胞增殖
免疫突触观察:共聚焦显微镜分析巨噬细胞-T细胞接触界面
8. 免疫调节者
分子机制:巨噬细胞通过分泌IL-10、PGE2等免疫抑制因子,或表达PD-L1、CD80/86等表面分子,直接调控T细胞功能。M2型巨噬细胞高表达精氨酸酶1(Arg-1),消耗微环境中精氨酸,抑制T细胞增殖。
检测方法:
细胞因子谱分析:Luminex多因子检测技术量化免疫调节因子
T细胞抑制实验:Transwell共培养系统评估巨噬细胞对T细胞功能的抑制
代谢物检测:质谱分析微环境精氨酸、色氨酸水平
表2:巨噬细胞能量代谢特征与免疫功能
9. 巨噬细胞-肌成纤维细胞转化(MMT)
分子机制:在TGF-β1等因子刺激下,巨噬细胞通过Smad2/3磷酸化启动间质转化程序,表达α-SMA、胶原蛋白等间质标志物,获得收缩和ECM分泌功能。此过程受microRNA调控网络(如miR-21)精细调节。
检测方法:
双标免疫荧光:共染F4/80(巨噬细胞标志)和α-SMA(肌成纤维细胞标志)
收缩实验:胶原凝胶收缩分析评估细胞收缩能力
单细胞测序:追踪转录组动态变化
10. 细胞衰老表现
分子机制:端粒缩短、DNA损伤、线粒体功能障碍等因素激活p53/p21和p16/Rb通路,诱导巨噬细胞衰老。衰老巨噬细胞分泌大量炎性因子(SASP),如IL-6、MMPs,形成促炎微环境。
检测方法:
SA-β-gal染色:pH6.0下检测β-半乳糖苷酶活性
SASP因子检测:ELISA定量IL-6、IL-8等分泌水平
免疫荧光:检测γH2AX焦点(DNA损伤标志)
11. 单核-巨噬细胞转化
分子机制:单核细胞进入组织后,在M-CSF微环境中通过激活PU.1和MAFB转录因子网络分化为巨噬细胞。TAMs分化则受肿瘤微环境特定因子(如IL-4、IL-13)驱动。
检测方法:
表面标志分析:流式检测CD14(单核)→CD68(巨噬)的动态变化
趋化迁移实验:Transwell评估单核细胞向组织趋化因子(如CCL2)的迁移能力
谱系追踪:荧光报告基因标记单核细胞,活体观察分化过程
12. 泡沫细胞形成
分子机制:oxLDL通过CD36和SR-A受体被巨噬细胞过量摄取,而胆固醇外排蛋白(ABCA1/G1)表达不足,导致脂质蓄积。高表达的Hmox1驱动铁死亡,加剧泡沫细胞死亡和斑块不稳定。
检测方法:
油红O染色:冰冻切片显示胞内脂滴
胆固醇含量测定:酶法或质谱定量游离/酯化胆固醇
氧化应激检测:MDA、4-HNE等脂质过氧化产物定量
13. 炎症部位招募者
分子机制:组织损伤细胞释放CCL2、CX3CL1等趋化因子,与巨噬细胞表面CCR2、CX3CR1受体结合,激活PI3K/Rho GTPase通路,介导细胞定向迁移。乳酸、琥珀酸等代谢物也可作为趋化信号。
检测方法:
活体成像:双光子显微镜实时观察巨噬细胞迁移
趋化分析:Boyden小室或微流控芯片量化趋化反应
多色免疫荧光:组织原位分析巨噬细胞空间分布
14. 程序性死亡经历者
分子机制:
焦亡:炎症小体激活caspase-1/-11→切割GSDMD→细胞膜穿孔
凋亡:线虫体激活caspase-9→效应caspase→DNA片段化
坏死性凋亡:RIPK1/RIPK3激活MLKL→膜破裂
检测方法:
LDH释放:检测细胞膜完整性
caspase活性:荧光底物检测特异性caspase活化
Western blot:分析GSDMD、MLKL等蛋白切割/磷酸化
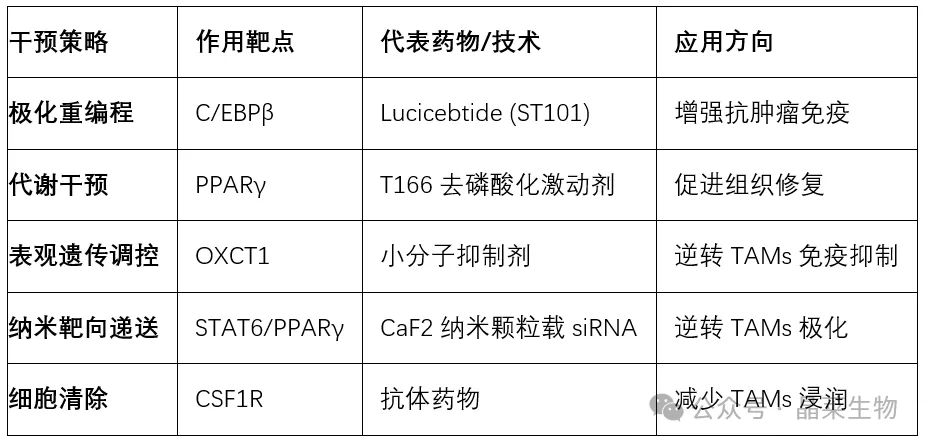
表3:巨噬细胞靶向治疗策略及其应用
巨噬细胞的转化医学价值
巨噬细胞作为免疫系统的“多面手”,其功能多样性既是生理维持的基础,也是疾病干预的靶点。从发育生物学角度看,巨噬细胞的胚胎起源决定了其组织特异性功能,如小胶质细胞的中枢免疫监视和PraM的促血管生成功能。从病理角度看,巨噬细胞极化失衡是多种疾病的共性特征:在肿瘤中M2型TAMs促进免疫逃逸,在纤维化疾病中MMT加剧ECM沉积,在动脉粥样硬化中泡沫细胞形成导致斑块不稳定。
基于巨噬细胞可塑性的治疗策略正从基础研究走向临床:
重编程策略:如C/EBPβ拮抗剂lucicebtide逆转TAMs免疫抑制
代谢干预:阻断OXCT1逆转琥珀酸介导的T细胞抑制
靶向递送:CaF2纳米颗粒递送siRNA靶向STAT6/PPARγ通路
联合免疫治疗:IL-8受体拮抗剂联合抗PD-1增强T细胞浸润
关于晶莱