
时间:2020-03-17浏览次数:8871
Ⅱ型糖尿病(T2DM)是一种以胰岛素抵抗和胰岛β细胞功能受损为特征的代谢性疾病。在基础研究和药物开发中,构建稳定可靠的大小鼠模型是研究其发病机制和干预手段的关键。
II型糖尿病(T2DM)的动物模型构建需模拟其核心病理特征:胰岛素抵抗(IR)和胰岛β细胞功能障碍。以下从造模方法、分子机制、关键蛋白及临床研究四部分系统阐述。
一、自发性模型
1. ob/ob小鼠(瘦素缺陷型)
造模机制:Leptin基因突变导致瘦素缺乏,引发下丘脑摄食中枢失调→过度摄食→肥胖→胰岛素抵抗。
关键通路:
瘦素信号通路:JAK2/STAT3磷酸化受阻,促炎因子(TNF-α、IL-6)分泌↑。
AMPK通路:能量代谢失衡,骨骼肌葡萄糖摄取↓。
PI3K/Akt通路:胰岛素信号传导障碍,GLUT4转位受阻。
关键蛋白:Leptin、IRS-1、GLUT4、SOCS3(负调控因子)。
临床关联:用于GLP-1受体激动剂(如利拉鲁肽)的疗效验证,模拟肥胖相关T2DM患者代谢改善机制。
2. db/db小鼠(瘦素受体缺陷型)
机制特点:Leptin受体缺陷→瘦素抵抗→更严重的IR和β细胞凋亡(Bax/Bcl-2失衡)。
关键通路:
内质网应激:CHOP激活→β细胞凋亡。
NF-κB通路:慢性炎症加重IR。
关键蛋白:PERK、IRE1α、XBP1(内质网应激标记物)。
临床研究:SGLT2抑制剂(如恩格列净)在此模型中显示肾脏保护作用,与临床糖尿病肾病研究一致。
二、饮食诱导模型
1. 高脂饮食(HFD)模型
造模方法:60%脂肪供能饮食喂养8-12周。
机制通路:
脂毒性:FFAs通过TLR4激活→JNK/NF-κB通路→IRS-1 Ser307磷酸化→IR。
氧化应激:ROS↑→Nrf2/Keap1失衡→线粒体功能障碍。
关键蛋白:SREBP-1c(脂合成调控)、PPARγ(脂肪分化)、UCP2(能量解偶联)。
临床关联:模拟代谢综合征患者,用于研究二甲双胍改善肝糖异生的机制(AMPK激活)。
2. 高糖高脂联合模型
特点:加速β细胞去分化(FoxO1异常核转位)。
通路:
mTORC1通路:营养过剩→β细胞自噬抑制→功能衰竭。
临床研究:阿卡波糖(α-葡萄糖苷酶抑制剂)在此模型中延缓糖尿病进展,支持其在餐后血糖控制中的应用。
三、化学诱导模型
1. 链脲佐菌素(STZ)模型
造模优化:低剂量多次注射(30-40 mg/kg×5天)联合HFD,选择性破坏β细胞。
机制:STZ通过GLUT2进入β细胞→DNA烷基化→PARP过度激活→NAD+耗竭→细胞死亡。
关键蛋白:GLUT2、PARP-1、PDX-1(β细胞分化标记)。
临床关联:用于DPP-4抑制剂(如西格列汀)研究,验证其促进β细胞再生的潜力。
四、基因编辑模型
1. KK-Ay小鼠
基因背景:Agouti黄色基因过表达→中枢食欲失控+外周脂肪沉积。
通路:
PI3K/Akt/mTOR:骨骼肌糖原合成↓。
临床研究:PPARγ激动剂(如罗格列酮)在此模型中改善IR,但临床心血管风险提示需个体化用药。
2. β细胞特异性敲除模型(如IRS2⁻/⁻)
机制:IRS2缺失→PI3K/Akt信号中断→β细胞增殖能力丧失。
应用:用于GIP/GLP-1双受体激动剂(如Tirzepatide)的机制研究,证实其促进β细胞存活作用。
五、新兴模型
1. 肠道菌群失调模型
造模方法:抗生素处理+高脂饮食,或粪菌移植(来自T2DM患者)。
机制:SCFAs生成↓→肠屏障破坏→LPS入血→TLR4/MyD88通路激活→系统性炎症。
关键蛋白:GPR41/43(SCFAs受体)、ZO-1(紧密连接蛋白)。
临床关联:益生菌(如双歧杆菌)干预研究,部分临床试验显示HbA1c小幅降低。
六、模型选择与临床转化
药物开发:
GLP-1类似物:在db/db小鼠中减少β细胞凋亡→临床证实心血管获益。
SGLT2抑制剂:在ZDF大鼠中改善肾小球高滤过→临床降低心肾事件风险。
机制探索:
炎症靶点:TNF-α抑制剂在动物模型有效,但临床疗效有限,提示物种差异。
β细胞再生:Neurogenin3过表达在模型中有促分化作用,但临床转化尚需突破。
总结表:模型与临床对应
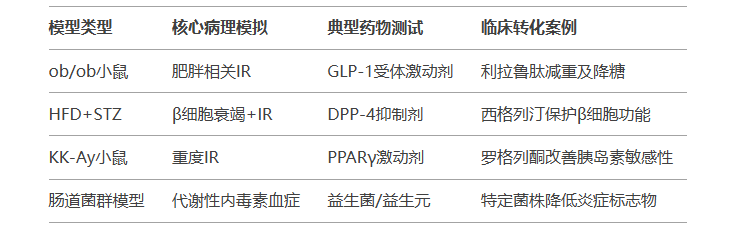
通过合理选择模型,可精准解析T2DM分子机制并加速药物研发。未来趋势包括多因素模型(如高龄+HFD+基因编辑)及类器官-动物模型联用,以更贴近人类疾病异质性。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

上一篇:亢甲状腺药物诱导的甲减模型
下一篇:1型糖尿病动物模型
