
时间:2020-12-03浏览次数:2728
肺间质纤维化(Pulmonary Fibrosis, PF)是一种以肺间质炎症和胶原沉积为特征的慢性疾病,动物模型是研究其发病机制和药物开发的重要工具。以下从造模方法、机制通路、关键蛋白及临床转化研究四个方面详细阐述。
一、常用动物模型造模方法及机制
博来霉素(Bleomycin)诱导模型
方法:气管内注射或雾化吸入博来霉素(啮齿类常用)。
机制:
博来霉素通过诱导DNA链断裂和自由基生成,触发肺泡上皮细胞(AECs)损伤。
损伤后释放促炎因子(如IL-1β、TNF-α),激活TGF-β/Smad通路,促进成纤维细胞向肌成纤维细胞转化(EMT/MEndT)。
胶原过度沉积,形成纤维化病灶(3-4周达峰,后期可能部分逆转)。
无机粉尘诱导模型(石棉/二氧化硅)
方法:气管内滴注石棉或二氧化硅颗粒。
机制:颗粒被巨噬细胞吞噬后激活NLRP3炎症小体,释放IL-1β和TNF-α。
通过TLR4/NF-κB通路增强炎症反应,上调TGF-β1表达,促进胶原合成。
长期暴露导致慢性纤维化(更接近职业性肺病模型)。
辐射诱导模型
方法:胸部局部照射(单次高剂量,如15-20 Gy)。
机制:
辐射产生活性氧(ROS),直接损伤AECs和内皮细胞。
激活Wnt/β-catenin通路和TGF-β1信号,抑制上皮修复,促进纤维化。
慢性进展(数月至数年),模拟特发性肺纤维化(IPF)。
方法:
TGF-β1过表达:诱导持续纤维化。
SP-C突变(如SP-C^Δexon4):导致肺泡Ⅱ型上皮细胞(AT2)内质网应激。
机制:基因异常直接激活纤维化通路(如ERS/UPR、EMT),模拟遗传性PF。
二、核心信号通路与关键蛋白
TGF-β/Smad通路
关键蛋白:TGF-β1、Smad2/3、Smad7(抑制因子)。
作用:促进成纤维细胞增殖、EMT及胶原合成。临床药物(如吡非尼酮)靶向抑制此通路。
Wnt/β-catenin通路
关键蛋白:Wnt3a、β-catenin、GSK-3β。
作用:抑制肺泡上皮再生,促进成纤维细胞活化。抑制剂(如ICG-001)在临床试验中。
PI3K/Akt/mTOR通路
关键蛋白:PI3K、Akt、mTOR。
作用:调控细胞存活、自噬和胶原代谢。雷帕霉素(mTOR抑制剂)在动物模型中显示抗纤维化效果。
MAPK通路(ERK/JNK/p38)
关键蛋白:ERK1/2、JNK、p38 MAPK。
作用:介导炎症和纤维化信号传导,尼达尼布部分通过抑制MAPK起效。
氧化应激与炎症小体
关键蛋白:NLRP3、ASC、Caspase-1、IL-1β。
作用:驱动炎症向纤维化转化,靶向NLRP3的抑制剂(如MCC950)处于临床前研究。
三、纤维化相关标志性蛋白
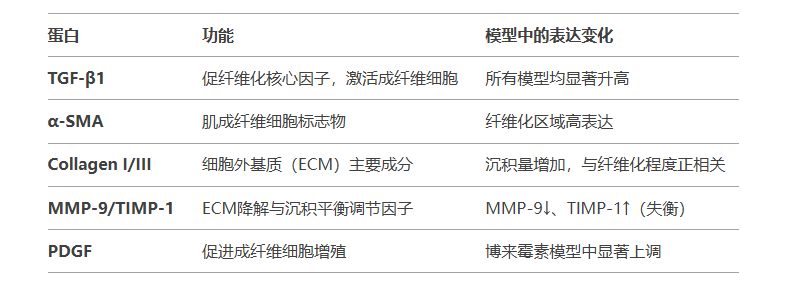
四、临床转化研究进展
靶向TGF-β通路
吡非尼酮:抑制TGF-β1合成,降低胶原沉积(已获批用于IPF)。
抗TGF-β单抗(如GC1008):临床试验显示部分患者肺功能改善。
抗炎症小体治疗
Anakinra(IL-1受体拮抗剂):针对NLRP3炎症小体下游,正在II期试验中。
抗纤维化多靶点药物
尼达尼布:抑制PDGFR、FGFR、VEGFR,减缓肺功能下降(一线治疗药物)。
基因与细胞治疗
miR-29 mimics:在动物模型中抑制胶原合成,临床试验(NCT02603224)进行中。
间充质干细胞(MSCs):通过旁分泌作用调节免疫和促进修复,多项II期试验评估中。
靶向EMT/MEndT
针对Snail/Slug转录因子:临床前研究显示抑制EMT可减轻纤维化。
五、模型总结和未来研究方向
模型选择:博来霉素模型适合急性机制研究,转基因模型更适合慢性或遗传性PF。
转化瓶颈:动物模型无法完全模拟人类IPF的复杂性(如衰老、环境因素)。
未来方向:多组学技术(单细胞测序、空间转录组)助力解析异质性,个体化治疗是趋势。
通过深入理解不同模型的分子机制,结合临床转化研究,有望开发更精准的抗肺纤维化疗法。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

上一篇:急性肺损伤模型
下一篇:慢性支气管炎动物模型
