
时间:2025-09-11浏览次数:238
类器官(Organoids)指利用成体干细胞或多能干细胞进行体外三维(3D)培养而形成的具有一定空间结构的组织类似物。尽管类器官并不是真正意义上的人体器官,但能在结构和功能上模拟真实器官,能够最大程度地模拟体内组织结构及功能并能够长期稳定传代培养。
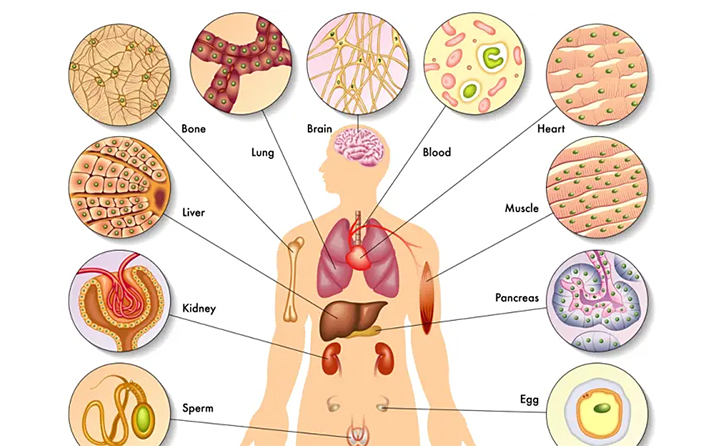
人源结直肠癌类器官是一种基于结直肠癌患者来源肿瘤细胞搭建的体外三维模型,通过引入细胞外基质、营养物质、生长因子以及小分子化合物等,在体外模拟结直肠癌细胞的生长微环境,促使患者来源肿瘤细胞自我增殖并组装成结直肠癌类器官。这种模型与结直肠肿瘤组织在细胞特性、分子特征和异质性等方面高度相似,可实现体外长期培养和使用,成为新型结直肠癌研究模型,补充了结直肠癌细胞系和异种移植模型的不足。
实验仪器材料
1、仪器
CO2培养箱、双人单面超净台、倒置显微镜、低温水平式离心机、低温冰箱
2、材料
细胞培养板(规格为 24孔、48孔和96孔)、离心管(规格为 1.5mL、15mL和50mL)、细胞培养皿 (直径规格为 2.5cm和 6cm) 、移液器 (规格为 2.5μL、10μL、20μL、200μL、1000μL)、无菌吸头 (规格为 10μL、200μL、1000μL )、无菌镊子、无菌组织剪、细胞过滤器 (滤网孔径为 70μm 和 100μm)、基质胶培养基、无菌含有双抗的冰PBS
3、操作流程
①组织样本预处理
在超净台内,将组织从原代组织保存液中取出,放入无菌培养皿中,用含有双抗的PBS抽吸冲洗15遍后,放置于盛有组织缓冲液的无菌培养皿中,对样本进行试验前状态记录。
使用无菌镊子尽可能清理掉所有坏死组织及非上皮组织(例如肌肉或脂肪、结缔组织),在培养皿或离心管中用无菌的剪刀/手术刀,对样本进行机械分离,将大块的组织分离成为大约0.5-2 mm3 的细小碎片或糊糜状。(剁碎至组织不卡1mL枪头为最佳)
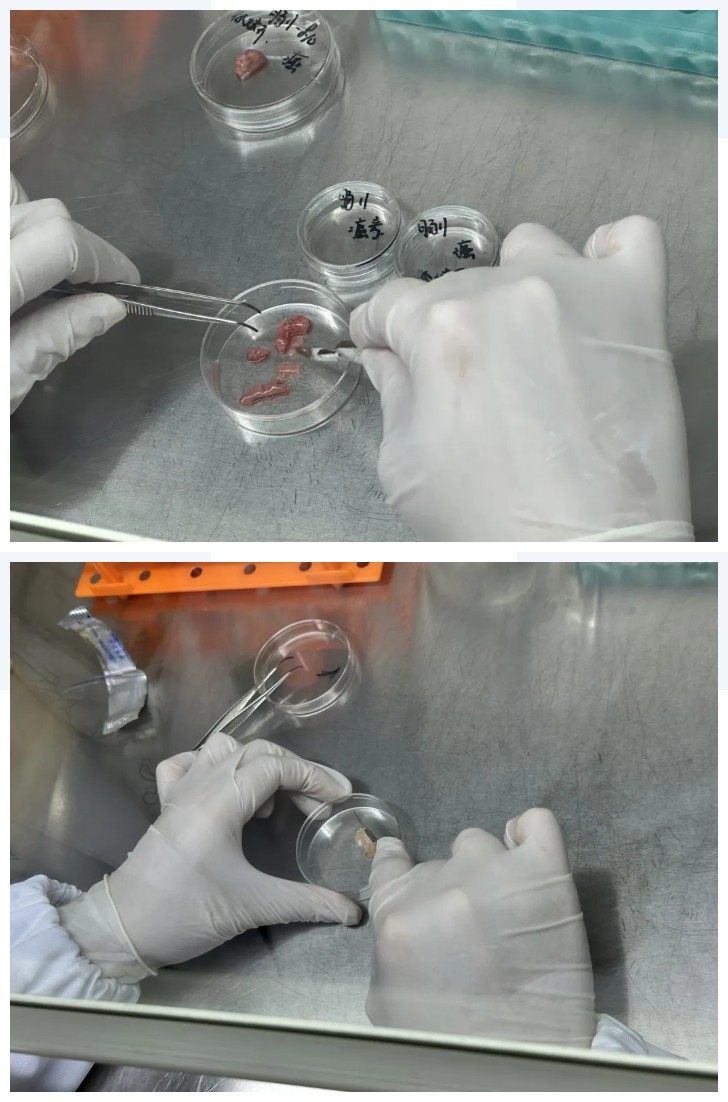
②消化液消化-终止
将经过剁碎好的组织,完全转移至 15 mL 无菌离心管中,并加入50倍剪碎组织悬液体积的组织消化液重悬,用 1 mL 枪头轻轻吹打组织,使其充分分散;将含有该消化液的离心管放置于恒温震荡培养箱,37℃ 条件下,1200 rpm 的转速消化分离20-40分钟,每隔10min均匀取10μL悬液到96孔进行镜检观察,观察到有大量的类器官形态的细胞团块则即可终止消化。
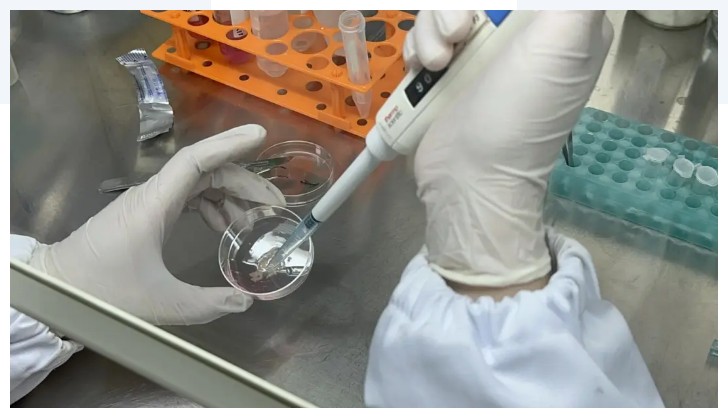
在消化完成的组织悬液中加入胎牛血清至终浓度达2%-4%以减缓消化作用,同时轻轻吹打10次以上。用 100μm的筛网将细胞悬液过滤进入新的15mL离心管中,用无菌 PBS 清洗筛网。
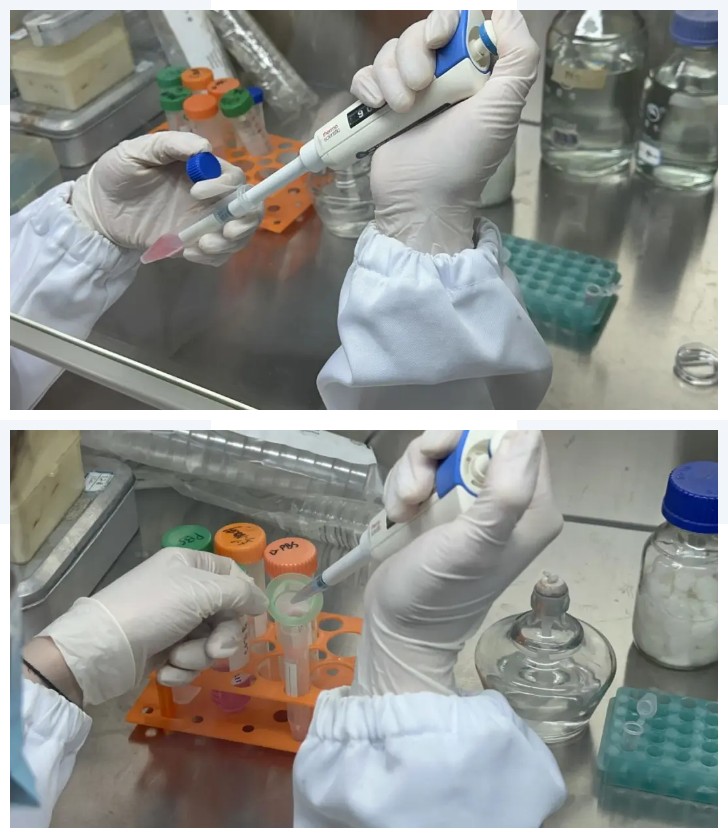
③细胞洗涤
将上述含有细胞滤液的离心管在4℃,1,200 rpm 条件下离心 3 min,小心去除上清。沉淀细胞用 PBS 清洗一次;向细胞沉淀中加入适量的细胞培养液,轻轻吹打制成单细胞悬液,4℃,1,200 rpm 条件下离心 3 min。
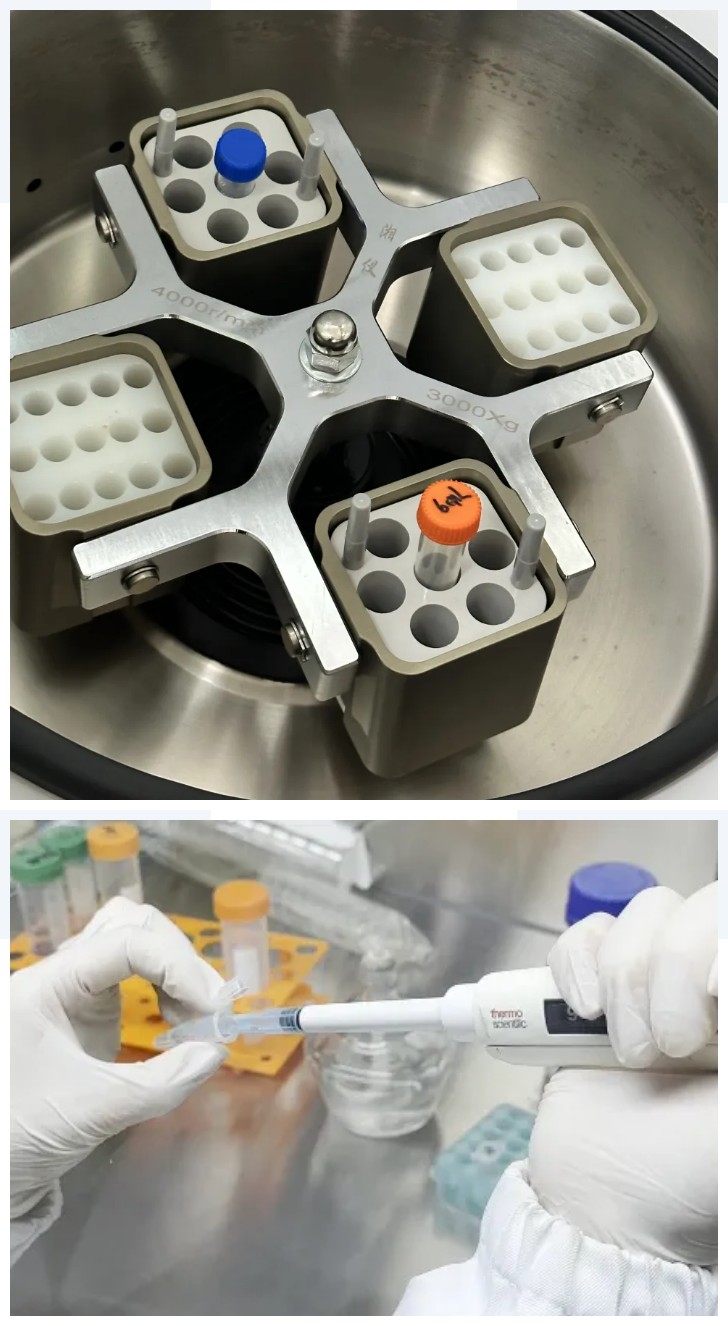
④原代组织样本细胞活力检测
取少量终止消化后的细胞悬液进行原代组织样本质量检测(一般选用台盼蓝计数染色,总细胞活力大于90%以上且总细胞量在104以上表明该原代组织样本质量良好)。
⑤基质胶3D包裹
检测剩余细胞悬液,于 200~300g离心力离心 3-5分钟,吸去上清液保留沉淀,按每孔8000-10000个细胞对应20-30μL基质胶的比例计算加入相应量的类器官基质胶(以24 孔板为例),并在冰上混匀(注意,混匀吹打的动作要轻柔,切忌产生大量气泡常温混匀则需要控制在 15 秒内) ,混匀后置于冰上。
注意:为确保培养过程中类器官基质胶的结构稳定性,应保持基质胶的体积比在70%以上。
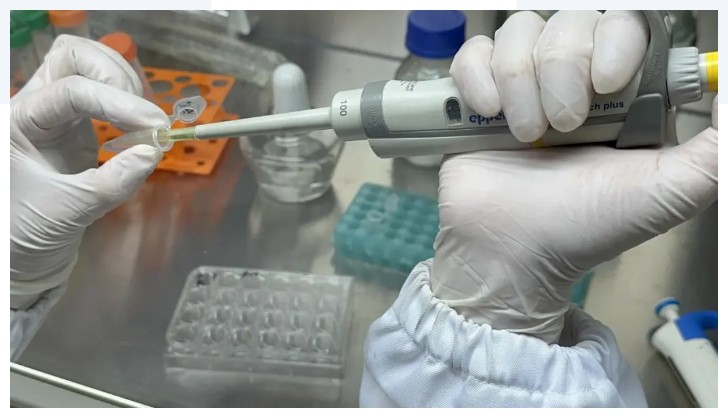
⑥种板培养
用移液器吸取基质胶和细胞的混合液移至细胞培养孔板中,(如 24 孔细胞培养板每孔点20 ~30μL混合悬液),混合悬液须点至培养孔底部中央位置,其铺开后不可接触培养孔侧壁。将培养板放入37℃、5%CO2细胞培养箱中凝固30分钟。待基质胶凝固至不再流动后,沿孔壁缓缓加入完全培养基(以24孔为例,加500μL完全培养基),将24孔板置于5%CO2细胞培养箱中培养,每3-4天更换一次完全培养基。
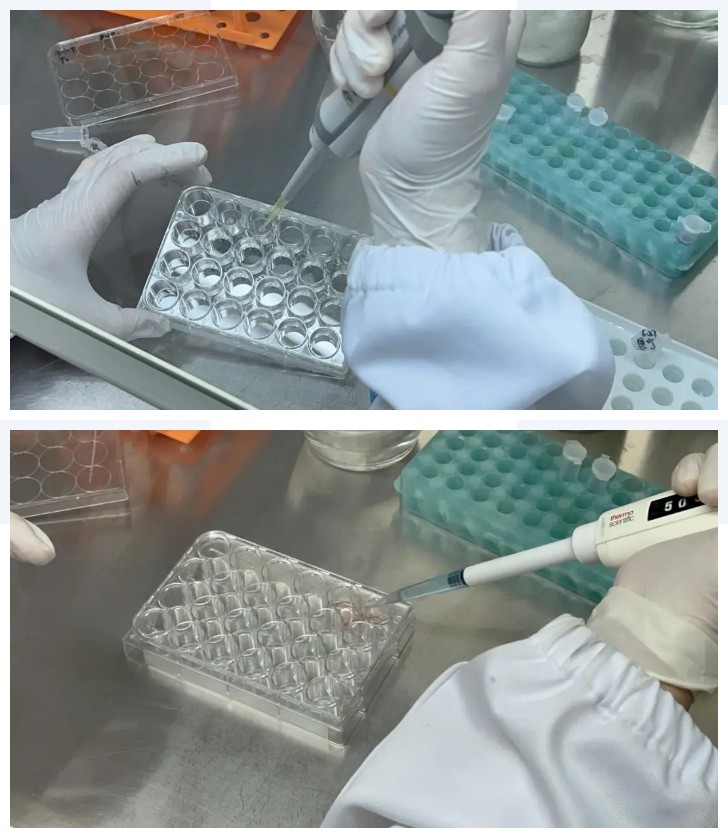
⑦组织类器官观察
将细胞培养板放入培养箱中进行培养,每天观察类器官并拍照,了解初始类器官数量、增殖速度、形态、微生物污染情况等。
下一篇:IPS/ES类器官培养
