泛凋亡(PANoptosis)研究方向的方法学梳理与机制分析!
时间:2025-04-29 阅读:772
泛凋亡(PANoptosis)作为近年来细胞死亡研究领域的新兴热点,其复杂的机制和跨通路的调控特性为疾病治疗提供了全新视角。以下从研究方法、机制通路、动物模型构建及检测验证四个维度进行系统梳理,并结合实际研究案例提出建议。
1. 多组学整合与分子互作分析
① 转录组/蛋白组学:通过单细胞RNA测序(scRNA-seq)和蛋白质互作组学(如IP-MS)筛选泛凋亡相关基因(如ZBP1、NLRP3、CASP8等)的动态表达及互作网络。
② 基因编辑技术:CRISPR-Cas9敲除/过表达关键基因(如FUNDC1、TAK1),验证其在泛凋亡中的调控作用。
③ 生物信息学分析:利用GEO、TCGA等数据库构建泛凋亡相关基因的预后模型(如HPAN-index),分析其与疾病分型、免疫微环境的关联。
2. 抑制剂与通路阻断实验
① 使用特异性抑制剂(如焦亡抑制剂Disulfiram、凋亡抑制剂Z-VAD-FMK、坏死性凋亡抑制剂Necrostatin-1)验证泛凋亡的独立性。
② 靶向关键分子(如TAK1、IRF1)的小分子药物或siRNA,评估其对泛凋亡复合体(PANoptosome)的调控作用。
1.核心调控网络
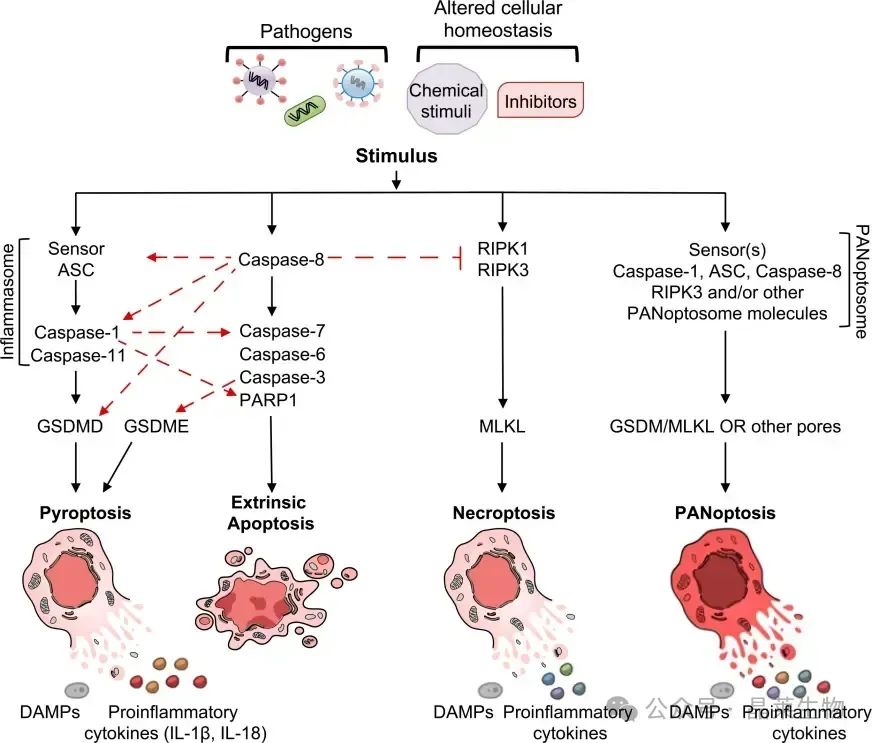
① 传感器与复合体组装:病原体相关分子模式(PAMPs)或损伤相关分子模式(DAMPs)激活ZBP1、AIM2等传感器,招募ASC、FADD等适配器,形成ZBP1-PANoptosome、AIM2-PANoptosome等复合体。
② 效应通路协同:复合体通过激活CASP1/3/8、RIPK1/3等效应分子,触发焦亡(GSDMD切割)、凋亡(CASP3激活)和坏死性凋亡(MLKL磷酸化)的协同效应。
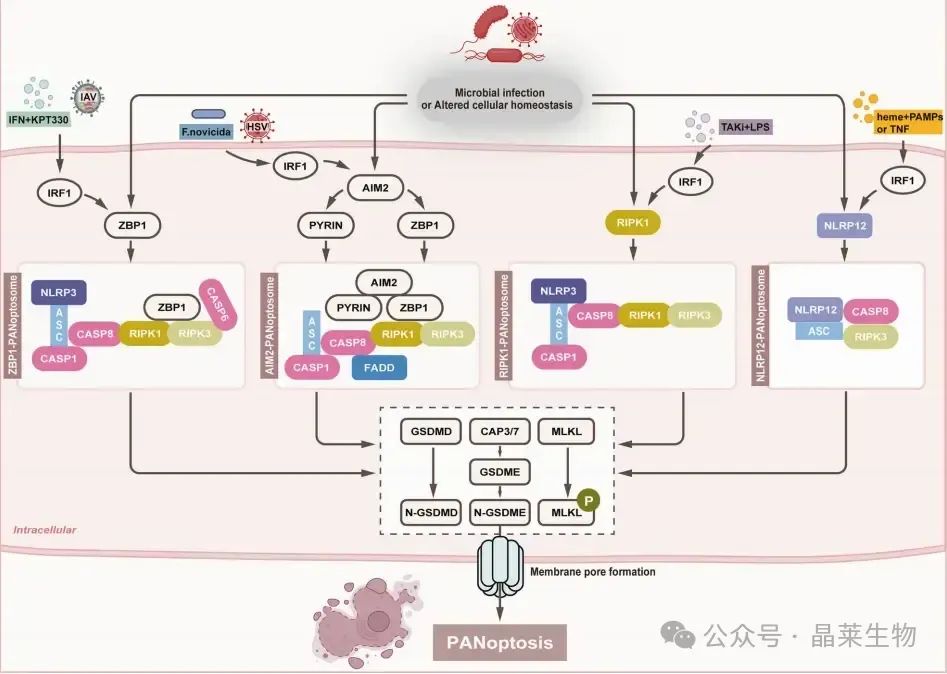
泛凋亡小体和泛凋亡的简要分子机制
2.信号转导的关键节点
① IRF1调控轴:在病毒感染(如IAV)或炎症刺激下,IRF1上调ZBP1表达,促进泛凋亡复合体形成。
② 线粒体损伤与mtDNA释放:线粒体膜蛋白FUNDC1通过稳定mtDNA减少胞质释放,抑制AIM2介导的泛凋亡。
1. 疾病模型的构建
① 感染与炎症模型:如甲型流感病毒(IAV)感染小鼠,模拟肺部泛凋亡激活;或使用LPS诱导的脓毒症模型,研究全身性炎症反应中的泛凋亡机制。
② 代谢与肿瘤模型:阿霉素诱导的心肌损伤模型(FUNDC1敲除小鼠);肝细胞癌(HCC)模型中结合泛凋亡基因分型与预后评估。
2. 基因修饰动物的应用
① 条件性敲除/过表达:如靶向神经元特异性敲除MC3R,研究其在脑缺血再灌注损伤中通过c-Fos/TAK1轴调控泛凋亡的机制。
② 多基因联合干预:通过NLRP3、RIPK3、CASP8三敲小鼠,验证泛凋亡复合体的必要性。
1. 形态学与分子标志物检测
① 形态观察:焦亡(细胞肿胀、膜破裂)、凋亡(染色质固缩)、坏死性凋亡(细胞膜完整性丧失)的共现。
② 多通路标志物联合检测:
焦亡:GSDMD-N端、CASP1/4活性;
凋亡:cCASP3、PARP剪切;
坏死性凋亡:p-MLKL、p-RIPK337。
2. 功能验证与动态监测
① 活体成像技术:利用荧光报告基因(如CASP3-GFP、MLKL-mCherry)实时监测泛凋亡时空动态。
② 代谢与免疫分析:通过scMetabolism评估单细胞代谢活性,结合流式细胞术分析免疫细胞浸润(如促炎单核细胞)。
1. 临床转化潜力:靶向泛凋亡关键节点(如TAK1、ZBP1)的药物开发,需平衡抗炎与促死亡效应(如肿瘤治疗中避免心肌毒性)。
2. 组织特异性差异:不同疾病模型中泛凋亡的调控机制可能不同(如脑缺血与心肌损伤),需针对性优化干预策略。
3. 动态监测技术:开发高时空分辨率的检测工具(如纳米探针),解析泛凋亡在疾病进展中的动态变化。
4. 总结:泛凋亡研究需整合分子机制、动物模型与临床数据,通过多学科交叉(如生信分析、化学生物学)揭示其病理生理意义。作为导师,建议团队从疾病特异性问题切入(如COVID-19中的细胞因子风暴),结合基因编辑与动态监测技术,推动从基础到临床的转化研究。
关于晶莱