
时间:2020-12-03浏览次数:7958
牙周炎是一种由菌斑生物膜引发的慢性炎症性疾病,涉及牙周支持组织的破坏。动物模型在揭示其病理机制和开发治疗方法中至关重要。以下详细介绍五种常用模型的造模方法、机制通路、关键蛋白及临床关联。
1. 结扎诱导模型
造模方法:用丝线或钢丝结扎啮齿类(如大鼠、小鼠)磨牙,促进菌斑堆积,模拟人类牙周炎。
机制通路:
TLR/MyD88/NF-κB通路:结扎导致菌斑中病原体相关分子模式(PAMPs)激活Toll样受体(TLR2/4),通过MyD88依赖途径激活NF-κB,释放TNF-α、IL-1β等促炎因子。
RANKL/RANK/OPG通路:炎症因子上调RANKL表达,促进破骨细胞分化,导致牙槽骨吸收。
关键蛋白:TLR2/4、MyD88、NF-κB、TNF-α、IL-1β、RANKL、OPG。
临床研究:
牙周炎患者龈下菌斑中检出高水平的牙龈卟啉单胞菌(Pg)和齿垢密螺旋体(Td)。
抗炎治疗(如IL-1β抑制剂)在临床试验中显示减缓骨吸收。
2. 细菌注射模型
造模方法:将Pg等致病菌注射至动物(如小鼠)牙龈沟,直接诱导感染。
机制通路:
NLRP3炎症小体通路:Pg的脂多糖(LPS)激活TLR4,触发NLRP3炎症小体组装,释放IL-1β和IL-18。
补体系统:C3a/C5a增强炎症反应,加重组织破坏。
关键蛋白:LPS、TLR4、NLRP3、Caspase-1、IL-1β、C3a/C5a。
临床研究:
抗LPS抗体或NLRP3抑制剂(如MCC950)在动物模型中减少炎症,临床试验正在评估其疗效。
牙周炎患者血清中LPS水平与疾病严重程度相关。
3. 基因修饰模型
造模方法:使用基因敲除(如IL-10⁻/⁻小鼠)或过表达(如RANKL转基因小鼠)动物。
机制通路:
抗炎因子缺失:IL-10缺陷导致促炎因子(如TNF-α)不受抑制,加速骨破坏。
骨代谢失衡:RANKL过表达打破RANKL/OPG平衡,激活破骨细胞。
关键蛋白:IL-10、RANKL、OPG、STAT3。
临床研究:
IL-10基因多态性与侵袭性牙周炎风险相关。
抗RANKL药物(地诺单抗)在骨质疏松患者中减少牙槽骨吸收。
4. 饮食诱导模型
造模方法:高糖/高脂饮食诱导肥胖或糖尿病动物(如Zucker大鼠),模拟代谢异常相关牙周炎。
机制通路:
AGEs/RAGE通路:晚期糖基化终产物(AGEs)通过RAGE激活NF-κB,促进炎症。
氧化应激:ROS积累抑制抗氧化酶(SOD、GPx),加重组织损伤。
关键蛋白:AGEs、RAGE、SOD、GPx、NF-κB。
临床研究:
糖尿病患者龈沟液中AGEs水平升高,与牙周炎严重程度正相关。
抗氧化剂(如N-乙酰半胱氨酸)在临床试验中显示改善牙周指标。
5. 手术损伤模型
造模方法:手术翻瓣或骨缺损(如犬类模型),研究牙周组织再生。
机制通路:
Wnt/β-catenin通路:促进间充质干细胞向成骨细胞分化。
BMP/Smad通路:BMP-2激活Smad1/5/8,诱导骨形成。
关键蛋白:β-catenin、BMP-2、Runx2、OCN。
临床研究:
重组BMP-2凝胶在临床中用于牙周骨缺损再生,疗效显著。
干细胞疗法(如PDLSCs)在动物模型中促进牙周再生,临床试验处于早期阶段。
模型比较与临床转化
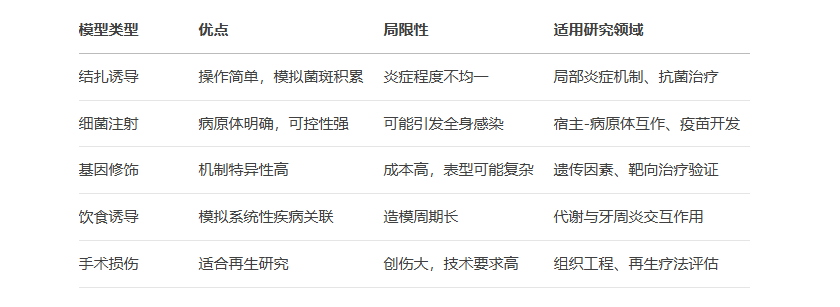
牙周炎动物模型通过不同机制模拟疾病进程,揭示了NF-κB、RANKL/OPG、Wnt等关键通路及蛋白的调控作用。临床研究基于这些发现开发了靶向治疗(如抗RANKL药物)和再生策略(如BMP-2应用)。未来研究需整合多模型优势,结合单细胞测序等新技术,推动精准牙周医学发展。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

