
时间:2020-03-17浏览次数:9769
白内障是一种眼球中晶状体部位由于各种原因发生混浊导致视觉障碍的疾病,其常见类型包括老年性白内障、并发性白内障、外伤性白内障、代谢性白内障等。白内障的初期症状通常不明显,但随病情发展,会出现视物模糊、复视、近视、眩光等症状,并可能导致患者完全失明。因此白内障的防治十分重要,构建白内障动物模型能有效研究白内障的发病机制和治疗药物。
以下是关于白内障动物模型不同造模方法及其机制通路、关键蛋白和相关临床研究的系统性阐述:
一、白内障动物模型的分类及造模方法
白内障动物模型主要分为以下四类,基于不同的病理机制构建:
1. 药物诱导模型
常用药物:亚硒酸钠(Na₂SeO₃)、链脲佐菌素(STZ)、糖皮质激素(地塞米松等)。
造模机制:
氧化应激:亚硒酸钠通过产生活性氧(ROS),破坏晶状体上皮细胞(LECs)的氧化还原平衡,导致细胞凋亡。
钙离子紊乱:糖皮质激素抑制钙泵活性,导致晶状体内钙超载,破坏细胞膜通透性。
关键蛋白与通路:
Nrf2/ARE通路:调控抗氧化酶(SOD、CAT、GPx)表达。
Bax/Bcl-2:介导线粒体依赖性凋亡。
钙调蛋白(Calmodulin):参与钙信号传导。
临床关联:
抗氧化剂治疗(如N-乙酰半胱氨酸)在临床试验中用于延缓白内障进展。
2. 物理损伤模型
方法:紫外线(UV)照射、电离辐射、机械穿刺。
造模机制:
晶状体蛋白变性:UV-B(280-315 nm)诱导α-晶状体蛋白(α-Crystallin)交联聚集。
DNA损伤:辐射通过p53通路触发LECs凋亡。
关键蛋白与通路:
αA-和αB-Crystallin:作为分子伴侣防止蛋白聚集。
MAPK/ERK通路:调控细胞应激反应。
TGF-β/Smad3:促进上皮-间质转化(EMT),导致后囊混浊。
临床关联:
抗紫外线眼镜和人工晶状体材料的改进基于此类模型研究。
3. 基因编辑模型
常见模型:
CRYAA/CRYAB敲除小鼠:模拟先天性白内障。
GJA8(Connexin 50)突变:导致晶状体纤维细胞通讯障碍。
造模机制:
晶状体蛋白结构异常:突变导致α/β/γ-Crystallin错误折叠。
离子通道功能障碍:Connexin缺陷干扰细胞间代谢物交换。
关键蛋白与通路:
热休克蛋白(HSP70):参与错误折叠蛋白的修复。
Wnt/β-catenin通路:调控晶状体上皮细胞增殖。
临床关联:
基因治疗(如AAV载体递送正常CRYAA基因)正在探索中。
4. 自然衰老模型
常用动物:老年犬、沙鼠(Meriones unguiculatus)、SAM(快速衰老小鼠)。
机制:
年龄相关氧化损伤:线粒体ROS累积导致谷胱甘肽(GSH)耗竭。
非酶糖基化:晚期糖基化终产物(AGEs)与晶状体蛋白交联。
关键蛋白与通路:
Sirtuin 1(SIRT1):通过去乙酰化延缓细胞衰老。
NF-κB通路:介导炎症反应。
临床关联:
抗衰老药物(如雷帕霉素)在临床试验中评估对白内障的预防效果。
二、模型选择与病理机制对应表
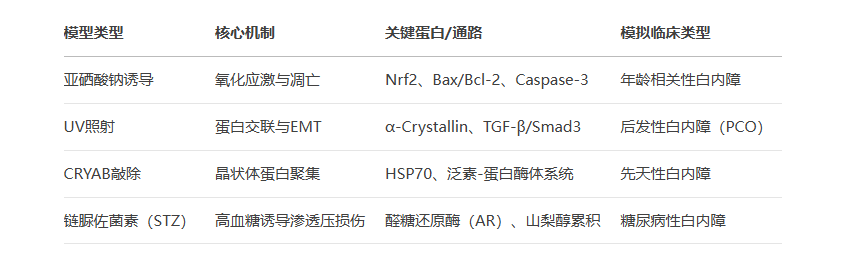
三、模型评价与局限性
药物诱导模型
优点:操作简单、成本低。
缺点:非特异性损伤可能影响其他器官。
基因编辑模型
优点:精准模拟遗传性白内障。
缺点:构建周期长,费用高昂。
自然衰老模型
优点:真实反映年龄相关病理。
缺点:实验周期过长(需12-24个月)。
四、转化医学与临床研究
抗氧化治疗
基础研究:Nrf2激动剂(如萝卜硫素)在动物模型中减少晶状体混浊。
临床试验:AREDS2研究显示维生素C/E可延缓白内障进展(证据等级B)。
分子伴侣疗法
基础研究:小分子化合物(如Lanosterol)逆转α-Crystallin聚集。
临床进展:滴眼液剂型Lanosterol已完成I期试验(NCT04653584)。
基因治疗
基础研究:CRISPR/Cas9修复CRYAA突变小鼠。
临床挑战:载体递送效率与安全性仍需优化。
五、模型总结与未来研究方向
白内障动物模型需根据研究目标(如氧化损伤、遗传突变或衰老)选择。未来趋势包括:
多因素模型:结合高血糖+UV照射模拟复杂病因。
类器官模型:人源晶状体类器官用于高通量药物筛选。
人工智能辅助:基于影像组学定量评估晶状体混浊程度。
通过模型与临床研究的深度整合,有望推动白内障的个性化治疗和早期干预策略。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

