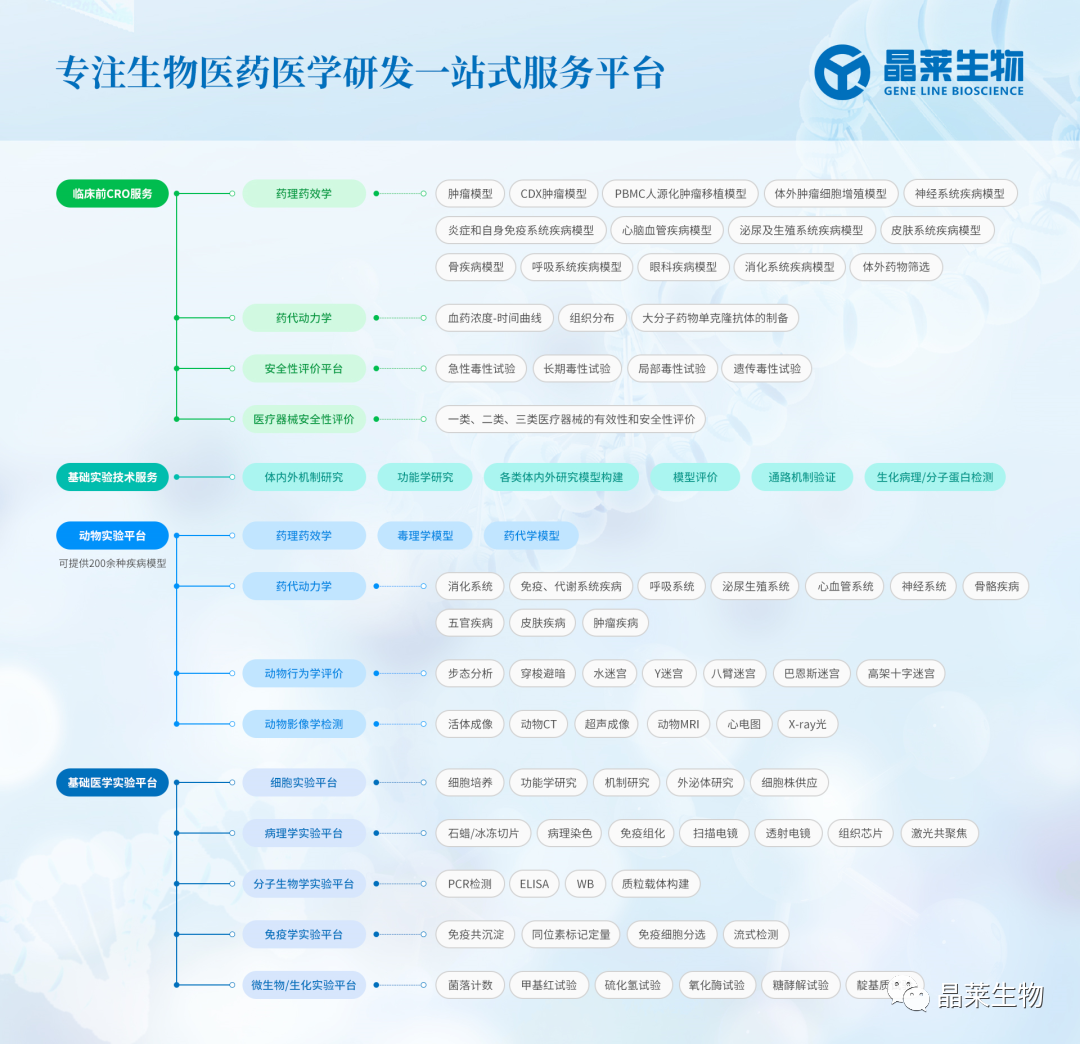
【五分钟讲实验】5分钟学会各类肿瘤动物模型构建及应用
时间:2023-09-18 阅读:1162肿瘤动物模型是用来模拟人类肿瘤在动物体内的发生、发展和治疗反应的实验动物。它们被广泛应用于肿瘤学研究,包括了解肿瘤的生物学特性、疾病机制、药物筛选和治疗效果评估等方面。
1. 定义
实验动物不经人为实验处理而自然发生的肿瘤,成为自发性肿瘤。
2. 实验动物选择
高发病率的实验动物一般选用小鼠(mouse)
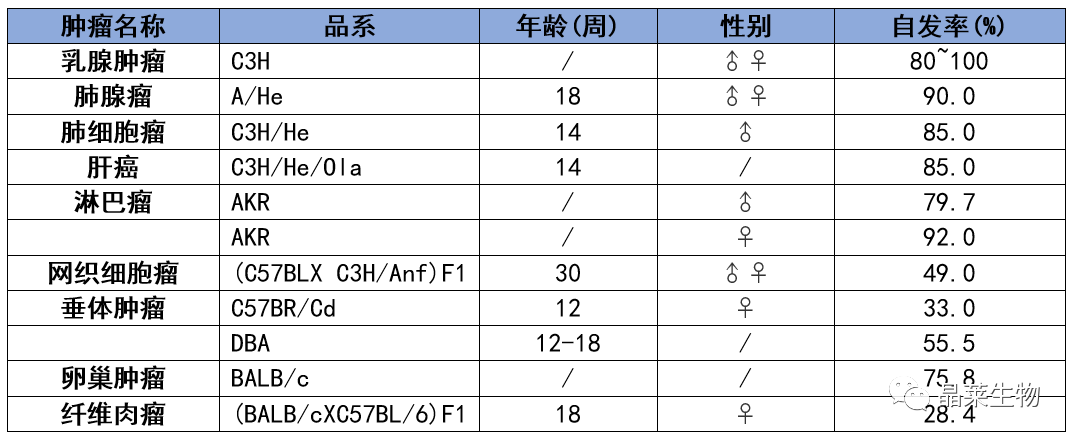
3. 常用肿瘤模型小鼠肿瘤自然发生率
4.自发性肿瘤动物模型优缺点
4.1 优点
①自然发生,肿瘤发生学与细胞学特点与人类肿瘤相似。
②便于慢性治疗及综合治疗。
③发生条件自然,可通过细致观察研究发现新的环境致癌因素及其他致癌因素;可以着重观察遗传因素在肿瘤发生中的作用。
4.2 缺点
①肿瘤发生情况参差不齐。
②难以短时间内获得大量肿瘤材料,耗时长,耗资大。
③发生肿瘤的动物肿瘤生长速度差异大,难以评价。
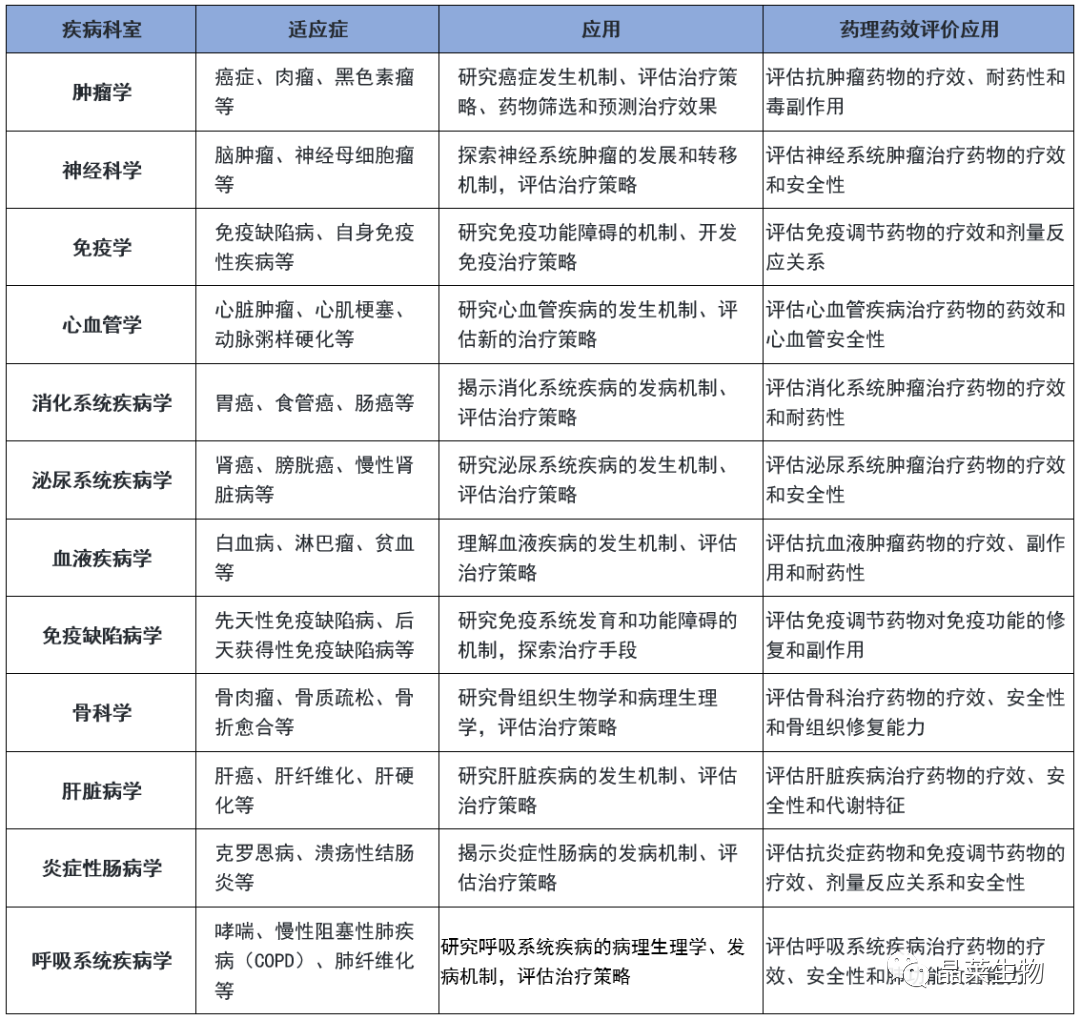
5.疾病科室、适应症及药理药效应用
1. 定义
使用致癌因素(Carcinogens)在实验条件下诱发动物发生肿瘤的动物模型。
2. 原理
利用外源性致癌因素引起细胞遗传特性异常而呈现出异常生长和高增殖活性,形成肿瘤。
3. 诱发性肿瘤模型动物选择
用于诱发实验性肿瘤的动物种类很多,以啮齿动物的使用最多、应用最广,包括各种大鼠、小鼠、豚鼠等。
4. 诱发性肿瘤模型优缺点
4.1优点:
①可控性:使用特定方法诱导肿瘤的形成,可以控制肿瘤的发展过程,以便更好地模拟人类肿瘤的发展。
②重复性:可以在多个动物实验中重复制备诱发性肿瘤模型,以确保实验结果的可靠性和重复性。
③可调性:可以根据需要选择不同的诱导方式和剂量,以研究不同类型和阶段的肿瘤发展。
④病理学相似性:该模型可以获得与人类肿瘤病理学特征相似的肿瘤组织样本,有助于深入研究肿瘤的病理学特点和分子机制。
4.2缺点
①物种限制:由于不同动物物种与人类的生物学特征存在差异,诱发性肿瘤模型可能无法完全模拟人类肿瘤的特点。
②成本和时间:建立和维护动物模型需要大量的资源、设备和时间成本。
③伦理问题:涉及使用动物进行实验,需要遵守伦理规范,确保动物的福利和安全。
④模型局限性:由于肿瘤的复杂性,诱发性肿瘤模型可能无法完全重现人类肿瘤的复杂性和异质性。
5. 诱发性肿瘤动物模型建立方法
①物理方法:
放射性物质致瘤,用放射线照射或局部注射放射性同位素。
②化学方法:
使用化学致癌物,如苯并芘(benzpy rene)、甲基胆蒽(MC)、联苯胺(benzidine )、亚硝胺类(nitrosamine )、黄曲霉素类(aflatoxin)等。
③生物方法:
用能诱发动物肿瘤的病毒致癌,如:小鼠白血病病毒,SV40病毒。
用转基因的方法诱发动物产生肿瘤,可根据启动子类型的不同选择不同的发瘤器官,如用乳球蛋白启动子的SV40T抗原的转基因小鼠,可诱发乳腺癌或胰腺癌。MMTV-Wnt-1转基因小鼠高发乳腺癌。
6. 诱发性肿瘤动物模型建立方法
①原位诱发:致癌物直接与动物靶组织或靶器官接触而诱发该组织或器官发生肿瘤。
②异位诱发:将与致癌物接触后的动物组织或器官埋置于该动物或另一正常动物皮下而 产生的该组织或器官的肿瘤。
7.诱发性肿瘤模型——致癌物给予途径
①涂抹法(皮肤癌)
②经口给药法(消化道或消化腺)
③注射法
④气管灌注法(肺癌)
⑤穿线法
⑥埋藏法
8.诱发性肿瘤模型——举例
8.1 肺癌
[简述]:在实验功物身上诱发肺癌,要比诱发其他肿瘤困难得多,诱癌率低,呼吸道给药的方法常常诱发多种肺外肿瘤而不是肺肿瘤。
[方法]:
①二乙基硝胺(DEN)诱发小鼠肺癌:小鼠每周皮下注射1%DEN水溶液1次,每次剂量为56mg/kg;
②乌拉坦诱发肺腺癌:小鼠(A系,1-1.5月龄)每次每只腹腔注入马拉坦生理盐水液0.1-0.3ml,间隔3-5日再注,共注2-3个月每只小鼠用量约为100mg
[特点]:
①DEN总量达868mg,观察时间为100天,发癌率可达40% ,DEN总量达1176mg,观察时间为半年时,发癌率可达94% ,其中支气管鳞状细胞癌占41%。
②乌拉坦注后3个月肺腺癌发生率为100%,且多数为多发性,诱发肺肿瘤的部位和组织分型与人类肺肿瘤相近似。
8.2 食管癌
[简述]:亚硝胺在体内经过代谢,产生重碳烷,使核酸或其他分子发生烷化而致癌.不对称亚硝胺口服或胃肠外给药,均能诱发大鼠食管癌。
[方法]:
①甲基苄基亚硝胺(MBNA)诱发食管癌:将1%MBNA溶液加在少量的粉末状饲料中,搅拌均匀,出1月龄以上Wistar大鼠自由摄食.结药量每天0.75~1.5mg/kg
②二烃黄樟素诱发大鼠食管癌模型:在大鼠饲料中加入微量(1/2500~1/10000)黄樟素喂养大鼠诱发率达20%一70%
[特点及应用]:MBNA诱发的食管癌可见食管鳞状细胞癌的组织,但很少发生转移;亚硝胺致癌性较强,大剂量1次给药,即可致癌。
8.3 肝癌
[简述]:常用口服致肝癌的物质有乙基亚硝胺(DEN),4-2甲基氨基偶氮苯(DBA)、2-乙酰氨基酸(2AAF).亚胺基偶氮甲苯OAAT和黄曲霉素。
[方法]:
①DEN诱发大鼠肝癌:取体重250g左右的封闭群大鼠给与0.25%DEN水溶液0.25-1mL灌胃或稀释10倍放在饮水瓶中自由饮水,剂量为每天2-10ml/kg,喂养半年左右
②黄曲霉素诱发大鼠肝癌:每月饲料中含0.001~0.015mg/kg混入饲料中喂6个月左右。
[特点及应用]:
DEN诱发大鼠致癌率为70%.DBA诱癌率为60%,黄曲霉素诱发大鼠肝癌发生率为80%,此种方法从病因学角度分析,与人体肿瘤较为近似,故此类模型常用于肿瘤特点的深入研究。
8.4 宫颈癌
用穿线法将附有0.1mg二甲基胆蒽(DMC)的棉沙线结穿入雌性小白鼠的宫颈部,并固定缝线。观察半年左右处死动物,取宫颈组织。
[应用]
这种方法可以用于建立宫颈癌模型,通过注入二甲基胆蒽和固定缝线,模拟宫颈癌的发展过程。通过观察和分析取得的宫颈组织,可以深入研究宫颈癌的发病机制、肿瘤生长和转移等方面的问题。
[特点]
高度控制:通过穿线法注入二甲基胆蒽,可以较好地控制药物的剂量和位置,确保实验结果的可靠性和可重复性。
较短的实验周期:由于使用强效致癌物质二甲基胆蒽,宫颈癌模型的形成速度相对较快,观察期限为半年左右,相对于其他方法,实验周期较短。
模拟性强:该方法可以更好地模拟宫颈癌的发展过程,使动物模型尽可能接近人类宫颈癌的生物学和病理学特征。
1. 定义
模型是指将动物或人体肿瘤移植到同种或异种动物体内连续传代而形成移植性肿瘤动物的肿瘤。
2. 实验动物选择
移植性肿瘤常用动物为小鼠、大鼠和地鼠。
3. 肿瘤细胞的选择
筛选抗癌药物时,最好选用3类瘤株,及肉瘤、腹水型肿瘤和白血病株。在众多移植性肿瘤中,小鼠Lewis肺癌、小鼠黑色素瘤B16及小鼠白血病P388是目前最受重视和应用最广的。
4. 移植性肿瘤动物模型优缺点
4.1优点
适应性广泛:可以使用不同来源的肿瘤细胞(人类或动物),以研究各种类型的肿瘤。
模拟性强:通过将人类或动物的肿瘤细胞移植到实验动物体内,能更好地模拟肿瘤在体内的生长和转移过程。
可控性高:可以根据需要调整移植的肿瘤细胞数量、部位和注射方式,从而控制肿瘤的形成和发展。
可重复性好:可以在多个实验动物中重复进行移植,以确保实验结果的可靠性和重复性。
用于评估抗肿瘤疗效:可以用来评估新的抗肿瘤药物和治疗方法的疗效和毒副作用。
4.2 缺点
物种差异:由于动物与人类在生物学特征和代谢方面存在差异,移植性肿瘤动物模型可能无法完全模拟人类肿瘤的复杂性和异质性。
免疫应答抑制:移植的肿瘤细胞在实验动物体内可能遭受免疫系统的攻击,导致肿瘤的生长受到限制。
实验周期较长:与诱发性肿瘤模型相比,移植性肿瘤模型需要更长的时间来观察肿瘤的形成和发展。
成本较高:建立和维护移植性肿瘤模型需要大量的资源、设备和时间成本。
5. 接种方法(无菌操作)
5.1 实体瘤

实体瘤接种法:瘤块接种法、瘤细胞悬液接种法、培养细胞接种法、活细胞接种方法等
5.2 瘤块接种法
选取接种后7~10d生长状态良好的瘤源动物,颈椎脱臼处死,消毒操作部位皮肤。切开皮肤,剥离出接种用的瘤块,剔除非肿瘤组织和坏死组织,选取生长良好而无变性坏死、淡红色(黑色素瘤则呈黑色或黑紫色)、鱼肉装的瘤组织,在无菌平皿内剪成2mm3小块。平皿放置在冰块上,平皿内放置少许灭菌的PBS或其它营养液。
用无菌套管针抽吸瘤块,接种于同种受体动物腋窝皮下(接种部位皮肤应先消毒)。也可取出肿瘤后切成小块,在受体动物的腋下剪开一个小口,用无齿眼科镊夹取瘤块,送入切口内。腋窝部皮肤松弛,能允许肿瘤生长的较大,宿主动物的寿命也可延长。接种操作的时间尽可能缩短,从瘤块取材到接种结束一般应在30min内完成。
5.3 瘤细胞悬液接种法
每次接种的动物数量较多时可采用此法。具体方法是:无菌操作取出瘤块,将数个瘤块混合后剪成小块,放入玻璃匀浆器中,加无菌生理盐水向一个方向转动研磨后,经滤网过滤,加生理盐水稀释成1:3~1:4(肿瘤g:生理盐水ml)的瘤细胞悬液,用台盼兰染色法计数活细胞数,用1ml注射器注射到接种部位,每个接种点接种0.2ml(一般含1×106~1×107个细胞数)。通常接种到腋窝皮下,每只动物可选用多个接种点。
将对数生长期细胞用0.25%胰蛋白酶消化脱壁后,用PBS或者生理盐水以1000r/min离心10min,洗涤2次,洗掉细胞中胰蛋白酶和培养液中血清等成分,用台盼蓝拒染法计数活细胞数,用生理盐水将肿瘤稀释成一定浓度的细胞悬液,细胞悬液置于冰上,使用1ml注射器在每个接种点接种0.2ml(含1×106~1×107个细胞),应尽快注射到接种部位。
1. 定义
这种模型使用人的肿瘤细胞,在病理组织形态和遗传特征等方面均与人类肿瘤相同,用这种模型可以比较直接的研究人类肿瘤的生物学特性及抗肿瘤药物。
2. 常用的模型动物:裸鼠和C57BL/6小鼠
3. 人体肿瘤异种移植性肿瘤模型优缺点
3.1 优点
生物学相似性:人体肿瘤异种移植模型能够保留原始人类肿瘤的某些特征和行为,具有一定的生物学相似性。
丰富的资源:可以使用临床收集的人类肿瘤样本,建立大量不同类型的异种移植性肿瘤模型,从而提供了丰富的资源供研究使用。
高通量筛选:该模型可用于高通量药物筛选,评估新的抗肿瘤化合物、靶向药物和免疫治疗方法的疗效。
个体化医学:通过使用来自患者的肿瘤样本,可以进行个体化医学研究,包括预测治疗反应和筛选最佳治疗方案。
3.2 缺点
物种差异:由于人类和非人类动物在生物学特征和代谢方面存在较大差异,移植后的肿瘤模型可能无法完全模拟人类肿瘤的复杂性和异质性。
免疫反应:由于异种移植,宿主免疫系统对移植的人类肿瘤细胞产生免疫反应,可能影响肿瘤的生长和发展。
缺乏肿瘤微环境:人体肿瘤异种移植模型缺乏人类肿瘤的真实微环境,包括肿瘤周围组织、血供和免疫细胞浸润等因素。
模型稳定性:异种移植的肿瘤模型可能具有较低的稳定性和可重复性,需要定期重新移植或使用新的样本来保持模型的活性。
4. 举例:裸鼠作为移植宿主
4.1 实验动物
在SPF屏障系统内繁殖生长的BALB/c裸小鼠,6~8周龄,体重21~22g。
4.2 瘤源
来源大致分两类,一类是人的肿瘤细胞株,另一类是源于人体肿瘤组织快的癌细胞。常用的人癌裸鼠细胞株、接种方法和最佳生长期为:结肠癌HCT-8(匀浆,3周)、胃癌MGC-803(组织块,4~5周)、肝癌BEL-7402(组织块,4周)、小细胞肺癌LTEP-SM1(组织块,4~5周)、乳腺癌MCF-7(组织块,4~5周)等。
4.3操作方法(例:人胃腺癌SGC-7901):
①超净台内将移植瘤剪成2~3mm3大小的瘤块,用套管针接种在BALB/c裸小鼠右侧腋窝皮下。
②接种24h后随机分组,开始给予受试药进行实验治疗,试验周期6周左右。
③停药次日,称体重,剥取肿瘤并称重,计算瘤重抑制率。
4.4 观察指标与疗效评价
①动物在接种肿瘤后6周左右形成1g以上的瘤块(平均瘤重),则表明移植肿瘤成功。
②如出现20%小鼠的瘤重小于400mg,则表示肿瘤生长不良。
③在药物治疗期间,如给药组小鼠死亡率超过20%或剥取肿瘤后平均体重下降超过15%(自身对照),表示药物存在毒性,应当减量重新实验。
④药效可根据给药后瘤重抑制率来评价,瘤重抑制率大于30%,并经统计学处理组间差异具有统计学意义时,表示该受试药有苗头。重复3次,如疗效稳定,评定该药有一定疗效.
注:肿瘤模型形成时间较长,需30~40d甚至更长。
在异种移植瘤实验中,还有一种正位移植,即将人癌组织或细胞按其在人体内的原发部位,接种于相应的器官,有别于通常的皮下接种(异位接种)。关于晶莱
关注公众号,了解更多!