
时间:2020-03-16浏览次数:4839
肾盂肾炎(Pyelonephritis)是上尿路感染累及肾脏肾盂和肾实质的炎症性疾病,常见病原体为大肠杆菌(UPEC)。动物模型是研究其发病机制、药物疗效和免疫反应的重要工具。以下从造模方法、机制通路、关键蛋白及临床研究关联四方面详细阐述。
一、常见造模方法及特点
1. 经尿道逆行感染模型(Ascending Infection Model)
操作:麻醉后通过导尿管将病原体(如UPEC)注入膀胱,模拟自然上行感染途径。
优点:接近人类感染路径,可研究细菌黏附、免疫应答及慢性化机制。
缺点:感染成功率受动物尿道解剖结构影响(雌性小鼠更易操作)。
2. 血源性感染模型(Hematogenous Spread Model)
操作:经尾静脉注射病原体,通过血液循环播散至肾脏。
适用场景:研究免疫抑制宿主(如糖尿病模型)的全身感染机制。
关键点:需联合肾损伤(如氯化汞预处理)促进细菌定植。
3. 梗阻模型(Obstructive Pyelonephritis Model)
操作:结扎单侧输尿管后接种细菌,模拟尿路梗阻诱发的感染。
机制:梗阻导致尿液滞留,削弱局部免疫,促进细菌增殖。
应用:研究肾积水合并感染的病理生理学。
4. 免疫缺陷模型
方法:使用基因敲除(如TLR4⁻/⁻、IL-8⁻/⁻)或药物诱导(如糖皮质激素)的免疫缺陷动物。
用途:揭示特定免疫通路在感染防御中的作用。
5. 基因修饰模型
举例:过表达人Tamm-Horsfall蛋白(THP)的小鼠,研究THP对细菌清除的影响。
6. 生物膜模型
操作:植入预形成生物膜的异物(如膀胱内导管)后接种细菌。
意义:模拟慢性/复发性感染中生物膜的耐药机制。
二、核心机制通路与关键蛋白
1. 细菌黏附与侵袭
关键蛋白:
UPEC的FimH菌毛:结合尿路上皮Gal-GalCer受体。
宿主Tamm-Horsfall蛋白(THP):抑制细菌黏附,敲除后感染加重。
通路:FimH-Gal-GalCer相互作用激活宿主细胞PI3K/Akt信号,促进细菌内化。
2. 先天免疫应答
TLR4/NF-κB通路:
TLR4:识别细菌LPS,激活MyD88依赖信号。
下游效应:释放IL-6、TNF-α、CXCL1等趋化因子,招募中性粒细胞。
临床关联:TLR4基因多态性与人类复发性肾盂肾炎风险相关。
3. 补体系统激活
关键成分:C3a、C5a促进炎症,C5b-9(膜攻击复合物)直接杀伤细菌。
模型证据:补体缺陷小鼠(C3⁻/⁻)感染后肾损伤加重。
4. 氧化应激与组织损伤
蛋白标志物:
Heme oxygenase-1 (HO-1):抗氧化应激,过表达可减轻肾损伤。
NOX2:产生活性氧(ROS),参与细菌清除但加重组织损伤。
5. 慢性化与纤维化
TGF-β/Smad通路:驱动肾间质纤维化。
关键蛋白:α-SMA(肌成纤维细胞标志)、Collagen I/III。
三、相关临床研究转化
1. 靶向TLR4通路的治疗
临床前证据:TLR4拮抗剂TAK-242在动物模型中减少炎症损伤。
临床试验:TAK-242用于脓毒症(NCT03491474),但尚未获批用于肾盂肾炎。
2. 补体抑制剂
药物:Eculizumab(抗C5单抗)用于非典型溶血尿毒综合征(aHUS)。
潜在应用:重症肾盂肾炎合并补体过度激活患者。
3. 抗生物膜策略
临床前研究:D-氨基酸联合抗生素破坏生物膜(Sci Transl Med, 2018)。
临床转化:膀胱灌注溶菌酶类似物(如LysEG28)的I期试验进行中。
4. 生物标志物开发
NGAL和KIM-1:尿液中升高提示急性肾损伤,已用于临床监测。
四、模型选择与实验设计建议
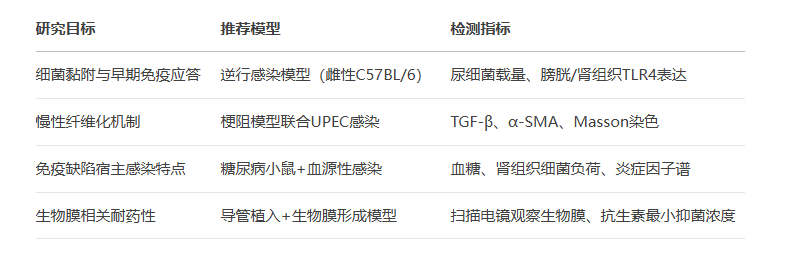
五、模型总结与未来研究方向
肾盂肾炎动物模型需根据研究问题选择,重点关注病理生理阶段(急性vs慢性)和宿主状态(免疫正常vs缺陷)。未来方向包括:
类器官模型:人源化肾类器官用于感染动态观察。
多组学整合:单细胞测序揭示免疫微环境异质性。
精准医疗:基于宿主遗传背景(如TLR4 SNP)的个体化治疗策略。
通过模型机制与临床研究的深度交叉,有望开发新型抗感染疗法及预后标志物。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

上一篇:急性肾衰竭动物模型
