
时间:2026-01-06浏览次数:186
类器官是利用成体干细胞或多能干细胞在体外进行3D培养以形成具有近似器官功能和组织结构,具有一定极性的多细胞结构。当前虽已研发出多种皮肤模型,但是体外模型可用的皮肤细胞来源较少,尤其是角质细胞,并且以目前的技术很难在体外培养扩增皮肤细胞。
一、人类器官重组表皮模型
晶莱生物以皮肤组织来源的表皮类器官为基础,构建了结构和功能与人体皮肤非常相似的三维表皮模型,可实现药物、化妆品原料及配方等的体外科学检测。
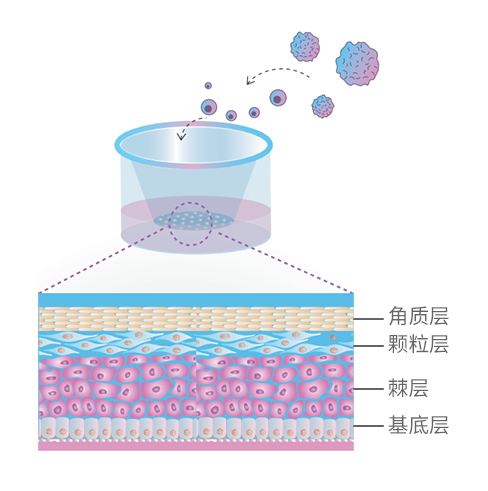
二、模型构建
三、操作前准备
离心机温度设定为 4℃预冷;
加样枪头提前放置-20 ℃预冷,于加样前取出;24 孔板提前放入 37℃恒温培养箱预热;
15mL 无菌离心管用润洗液润洗后置于冰上预冷;
将完全培养基从冰箱中取出,将温度平衡至室温;
DPBS 置于冰上预冷;
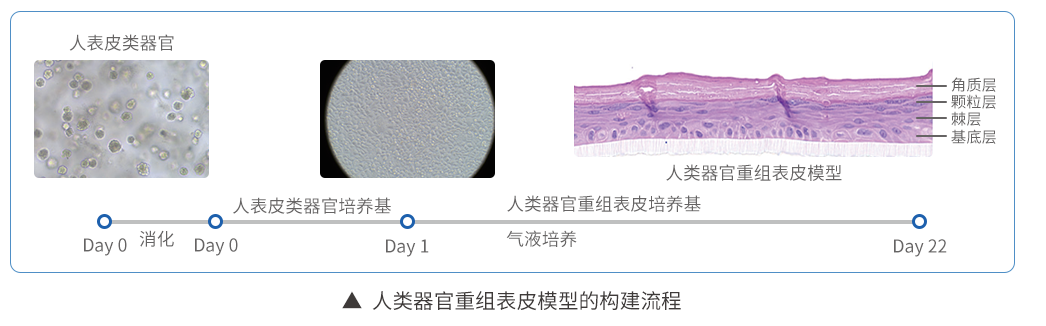
四、人类器官重组表皮模型构建
1. 取出培养板,在生物安全柜中沿孔边缘吸去培养基;
2. 每孔加入预冷的 500 μL DPBS,使用移液器吸头划胶使基质胶从板底脱落,使用无菌一次性吸管将类器官转移至 15 mL 离心 管;(注:无菌一次性吸管、移液器吸头、离心管等使用前需润洗; )
3. 用预冷 DPBS 定容,吹打混匀,使类器官从基质胶中洗脱出来;
4. 4℃,400 x g,离心 5 min;离心结束弃上清,保留沉淀;加入新的预冷 DPBS 6 mL, 1 mL枪头吹打混匀 20-30 次;
5. 4℃,400 x g,离心 5 min; 离心后弃去上清,保留沉淀,向离心管中加入 2 mL类器官消化液,37℃消化 7 min 后用 1 mL枪 头吹打混匀 10-20 次,再次37℃消化 7 min,用预冷 DPBS 定容至 6 mL;(注:消化并吹打结束后可取样镜下观察消化情 况,以类器官消化成单个细胞为宜;弃上清时操作要小心,避免吸液时类器官丢失;)
6. 4 ℃,400 x g,离心 5 min,离心后弃去上清,保留底部沉淀;
7. 加入预热的人表皮类器官培养基重悬沉淀;
8. 对表皮类器官单细胞计数,并使用人表皮类器官培养基调整体积为100 μL/模型;(注:建议每个模型接种1.65 x105 个细胞;)
9. 在培养板中每孔添加预热的800 μL人表皮类器官培养基,嵌入皿内层添加100 μL含人表皮类器官悬液,使嵌入皿内外液面相平; (注:加入细胞悬液后,不要移动培养板,在超净台内静置10min后再平稳移至37°培养箱,确保细胞均匀分布;)
10. 将培养板静置于37℃ CO2培养箱中24h,待细胞贴壁后,弃掉嵌入皿内层及培养板中的培养基,并用预热的DPBS轻柔清 洗嵌 入皿内层细胞3次,去除未贴壁的类器官;
11. 添加450L 预热的人类器官重组表皮培养基至嵌入皿外部,使液面与内层底面相平,进行气液培养;
12. 每2天更换人类器官重组表皮培养基,气液培养21天;( 注:观察嵌入皿上层是否含有液体,及时弃掉液体)
13. 气液培养21天后,可通过垂直切片对其进行鉴定。
五、模型维持培养
1. 添加450 μL 预热的人类器官重组表皮培养基至嵌入皿外部,使液面与内层底面相平,进行气液培养;
2. 每2天更换人类器官重组表皮培养基,继续气液培养( 注:观察嵌入皿上层是否含有液体,及时弃掉液体)。
五、刺激性测试
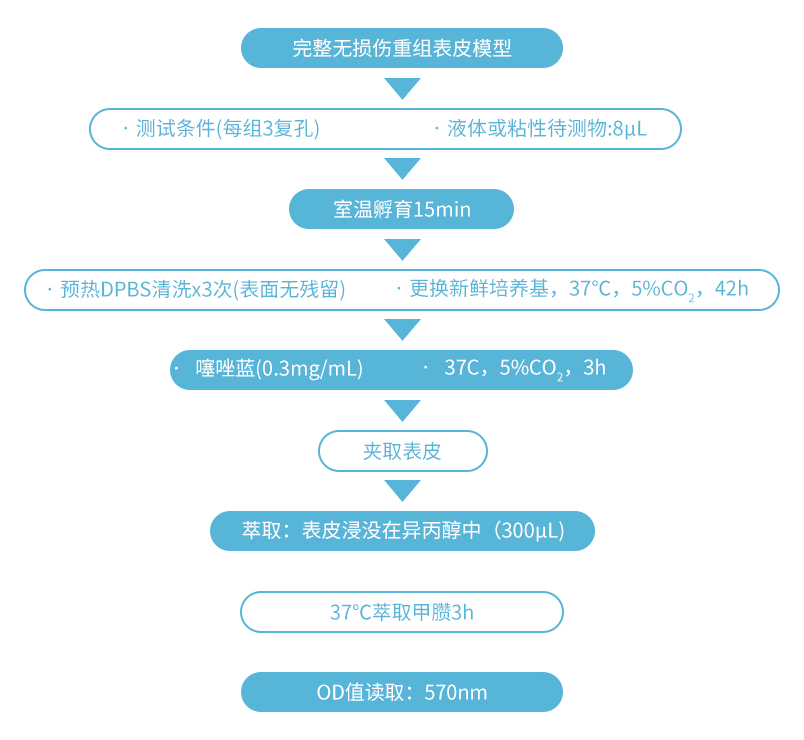
1、准备工作
1. SDS溶液配制:使用蒸馏水配制5%SDS,并 进行过滤。
2. 噻唑蓝母液配制:使用DPBS配制5mg/mL 噻唑蓝贮存液,避光贮存于-20℃。
3. 噻唑蓝工作液配制:使用
2、给药处理
1. 选取完整人类器官重组表皮模型并进行分 组:正常组给药蒸馏水、阳性组给药5% SDS和待测药物组,每组至少3个复孔。
2. 弃掉旧的培养基,更换新鲜人类器官重组表 皮培养基。
3. 在对应组别小室内层中心位置分别加入相应 蒸馏水、5%SDS和药物溶液各8μl,轻轻晃 动模型,使液体均匀润湿表皮模型表面。
4. 将模型静置于室温,给药干预15min。
5. 使用10μl枪头沿小室边缘吸掉药物,使用常 温DPBS轻柔清洗模型表面3次,注意操作 过程中尽量不要触碰模型表面。
6. 弃掉小室外层培养基,更换新鲜人类器官重 组表皮培养基,将模型放置于37℃,5% CO2培养箱孵育42h,使其恢复状态,再进 行细胞活力噻唑蓝检测。
3、细胞活力检测——噻唑蓝处理
1. 在小室外层添加500μL噻唑蓝工作液,内层添加100μL噻唑蓝工作液。
2. 37℃,5%CO2条件下进行孵育3h。
3. 噻唑蓝孵育结束后,轻轻弃掉小室内外层噻唑蓝工作液。
4. 使用镊子夹取小室内模型放置于96孔平底细胞培养板。
5. 每孔加入异丙醇300μL,多次吹打使其充分混匀。
6. 并于96孔板加300μL异丙醇,作为空白对照。
7. 37℃孵育3h。
8. 孵育结束后,再次吹打,使蓝紫色结晶甲臜完全溶解并混匀。从每孔中吸取200μL异丙醇浸提液,各自加入96孔板的对应孔 中,做好分组标记。
9. 于酶标仪570nm波长读取吸光度(OD)值。按以下公式计算相对细胞活力。相对细胞活力=(样品组OD值-空白对照OD值)/ (阴性对照OD值-空白对照OD值)*100%。
10. 细胞活力大于等于50%的化合物为非刺激性化合物;细胞活力小于50%的化合物为刺激性化合物。
上一篇:细胞3D模型构建
