
时间:2020-03-16浏览次数:5074
肾结石(Renal Urolithiasis,RU)动物模型。临床上尿石症是一种常见疾病,其中草酸钙结石占尿石症80%左右。目前,通常采用给大鼠以草酸或草酸前体,并辅以其他一些诱因如高钙饮食,维生素D饮食,大剂量抗生素等,诱导COM或COD晶体尿或草酸钙晶体在肾脏沉积,以促使大鼠形成肾结石,来模拟研究人类尿石的发病原因及评价晶体生长、聚集等促进或抑制因子在尿石形成中的作用。因此,大鼠草酸钙肾结石模型作为尿石症基础与临床研究的重要方法,已广泛用于尿石症的发病机制、药物疗效及药物筛选方面的研究。
肾结石的动物模型是研究其发病机制和潜在治疗手段的重要工具。以下从造模方法、机制通路、关键蛋白和相关临床研究四个方面展开详细阐述。
一、常用肾结石动物模型及造模方法
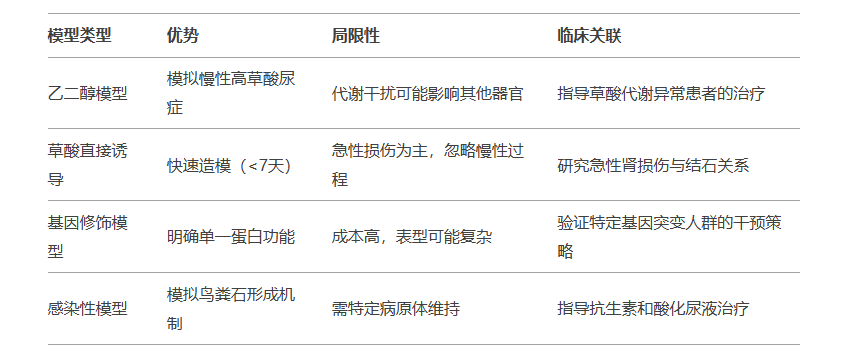
1.乙二醇(Ethylene Glycol, EG)诱导模型
方法:通过饮水或灌胃给予1%乙二醇(联合1%氯化铵),持续2-4周。
机制:乙二醇代谢为草酸,导致高草酸尿症,与尿钙结合形成草酸钙(CaOx)结晶,沉积于肾小管。
适用场景:模拟高草酸尿症相关结石(占人类结石的80%)。
2.草酸(Oxalate)直接诱导模型
方法:腹腔注射草酸钠(50-100 mg/kg)或口服草酸前体(羟脯氨酸)。
机制:直接增加尿草酸浓度,诱导CaOx晶体快速形成,损伤肾小管上皮细胞(RTECs)。
特点:造模周期短(1-2周),但急性损伤可能掩盖慢性机制。
3.基因修饰模型
THP基因敲除小鼠:Tamm-Horsfall蛋白(THP)缺失导致尿液黏度降低,CaOx晶体更易聚集。
OPN敲除小鼠:骨桥蛋白(OPN)缺失减少晶体与肾小管的黏附。
应用:验证特定蛋白在结石形成中的作用。
4.感染性结石模型
方法:经尿道接种产脲酶细菌(如变形杆菌),诱发磷酸镁铵(鸟粪石)结晶。
机制:脲酶分解尿素生成氨和CO₂,升高尿液pH,促进磷酸盐沉淀。
饮食诱导模型
高蛋白/高盐饮食:增加尿钙排泄。
低镁/低枸橼酸饮食:减少抑制结石形成的因子。
二、机制通路与关键蛋白
1.晶体形成与黏附
OPN(骨桥蛋白):促进CaOx晶体成核,但抑制生长(双重作用)。
THP(Tamm-Horsfall蛋白):生理条件下抑制晶体聚集,但低pH或高盐时促进聚集。
MCP-1(单核细胞趋化蛋白-1):介导炎症细胞浸润,加重晶体滞留。
2.氧化应激与炎症
ROS通路:草酸诱导RTECs产生活性氧(ROS),激活NADPH氧化酶(NOX4)。
NLRP3炎症小体:ROS触发NLRP3激活,释放IL-1β,促进炎症反应。
NF-κB通路:上调TNF-α、IL-6,加剧肾小管损伤。
3.细胞损伤与修复
凋亡通路:草酸激活Caspase-3,诱导RTECs凋亡,暴露基底膜促进晶体黏附。
自噬通路:LC3-II/Beclin-1表达上调,自噬抑制可加重结石形成。
4.离子转运调控
TRPV5/TRPV6:钙离子通道蛋白,高表达导致尿钙增多。
NaDC-1(钠-二羧酸转运体):促进枸橼酸重吸收,低枸橼酸尿促进结石。
三、相关临床研究及转化应用
1.抑制晶体黏附的靶点
OPN抑制剂:临床试验探索抗OPN抗体(如ASF-1096)对复发性结石的疗效。
THP基因多态性:人群研究发现THP基因突变与结石风险相关(OR=1.5-2.0)。
2.抗氧化治疗
维生素E/NAC:减少ROS生成,临床试验显示可降低结石复发率(RR降低30%)。
HO-1诱导剂(如血红素):激活Nrf2通路,减轻氧化损伤。
3.调节尿液成分
枸橼酸钾:临床一线用药,通过增加尿枸橼酸浓度抑制CaOx结晶。
镁补充剂:结合草酸,减少游离草酸排泄。
4.抗感染策略
脲酶抑制剂(乙酰氧肟酸):用于感染性结石患者,降低尿液pH和氨生成。
细菌生物膜靶向治疗:针对变形杆菌生物膜的纳米药物正在开发中。
四、模型选择与临床关联性
五、模型总结与未来研究方向
肾结石动物模型通过模拟不同病因(代谢、感染、遗传)揭示了关键通路(如氧化应激、晶体-细胞相互作用),并推动临床靶点(如OPN、TRPV5)的开发。未来需结合多组学技术(单细胞测序、代谢组学)和类器官模型,进一步解析结石形成的时空动态机制,促进精准治疗。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)

